
酒是伴随人类最久的加工饮品之一,主要由植物发酵制成。饮酒文化与人类共同发展,被广泛用于社交活动、饮食、食物保存和烹饪过程等。一般来说,饮酒以后会产生抑制中枢神经系统的作用,并随着喝酒量的增加,机体会产生愉悦、放松或步态紊乱等行为。但是,不健康的饮酒行为包括从难以自控的暴饮到酒精成瘾不仅能造成不良的个人健康和安全后果还会带来严重的经济与社会问题 1,2。据统计,全世界每年有近三亿人有这样的酒精使用障碍症状 (alcohol use disorder, AUD)。然而,当前对酒精使用障碍的形成机制所知有限,另外也缺乏有效的治疗方案与药物。另据世界卫生组织报道,截止 2019 年为止,全世界每年约有 260 万人死于饮酒。在中国,据统计人均酒精使用量从 2005 年的 4.1 升增加到 2016 年的 7.2 升,增幅有 76% 之巨 1。这说明与酒精相关的健康与社会问题在中国有变严重的趋势。在生理水平上,已有研究表明酒精能通过调节多种离子通道和受体的活性来调控大脑中的抑制性神经元和兴奋性神经元的激活,进而影响行为。另外,也有研究显示酒精可以调节多巴胺的释放,引起饮酒后的愉悦感 2-4。然而,尽管过去几十年已经取得很多进展,目前关于酒精如何在分子水平上靶向大脑神经元进而来调节饮酒相关的行为的机制仍不清楚。
近年来,美国国立卫生研究院国家神经疾病与中风研究所(NINDS)陆伟课题组一直在研究谷氨酸能兴奋性和 γ-氨基丁酸(GABA)能抑制性神经元的生理功能。课题组前期发现,膜蛋白 GSG1L 负向调节 α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPA 受体)介导的突触传递,比如 GSG1L 的过表达会抑制 AMPA 受体介导的突触传递,反之则会增强 AMPA 受体介导的突触传递 5。另外,在小鼠愿意付出更多的努力来获得更好的食物这一行为的研究中,课题组发现谷氨酸能传递到多巴胺能神经元的突触传递在奖赏动机行为中起到关键作用 6。在课题组主要研究方向,也就是研究抑制能突触的发育与功能方面,该团队首先证实了 N-甲基-D-天冬氨酸(NMDA 受体)在 GABA 能突触的发育中起到关键的作用,并进一步阐述了抑制性突触蛋白 Neuroligin 2 和 Slitrk3 如何在分子水平上相互作用调节 GABA 能突触的发育,并进而提出了 GABA 能突触发育的基本理论框架 7。该课题组在最近的工作发现了慢性压力能增强 Src 激酶的活性以及钙调蛋白的酪氨酸磷酸化,进而削弱了 MyosinVa(MyoVa)与 Neuroligin2(NL2)的相互作用,导致抑制性突触传递的减少并引发更强的焦虑样行为 8。在 GABAA 受体研究方面,其实验室发现 GABAA 受体的第一个能调控受体的动力学和药理学的辅助亚基,也就是单跨膜蛋白 Shisa79。实验室随后的一系列的工作表明 Shisa7 是能控制苯二氮卓类药物作用于 GABAA 受体并调节其降焦虑和麻醉效应的关键亚基 9。另外,Shisa7 还能调控 tonic 抑制电流,加快 GABAA 受体的关闭并降低受体单通道激活的频率 10-12。
2024 年 10 月 01 日, Cell 杂志在线发表了陆伟课题组的最新研究论文, 题为「The TMEM132B-GABAA receptor complex controls alcohol actions in the brain」( TMEM132B-GABAA 受体复合物调控酒精在大脑中的作用) 的研究论文。该研究发现一个新的单跨膜蛋白 TMEM132B,其能结合 GABAA 受体并增强酒精对 GABAA 受体的正变构效应,进而调节和酒精相关的行为。这项研究进一步丰富了该团队对于 GABAA 受体的系列开创性研究,为酒精行为效应的分子机制提供了新的视角,并为临床治疗酒精成瘾以及新药研发提供了可能的理论指导。

探寻大脑中与酗酒相关的蛋白
酒精在动物身上能引起很多行为反应,但其分子机制并不清楚。以前的研究发现酒精能结合大脑中的很多膜蛋白,包括多种离子通道和受体(这其中也包括 GABAA 受体),并改变它们的活性,进而改变神经元活性并引起行为变化。但在分子细胞和系统行为水平上,具体的酒精靶点在和酒精相关的行为中的具体作用还悬而未决。为了研究这些问题,作者从长期酗酒患者的大脑组织入手,来研究膜蛋白的表达水平是如何在酗酒患者的大脑中变化的。理解这些分子水平上的变化有可能能为酒精为什么能在动物身上引起多种行为反应的分子机制提供一些答案。因此,作者首先从 NIH 的人类脑库获得 6 个正常人和 6 个酗酒者的大脑海马组织,并通过对人类大脑海马膜蛋白进行分离纯化和定量质谱学分析,找到一系列在表达水平上有变化的膜蛋白。进一步分析发现,新的跨膜蛋白 TMEM132B 在长期酗酒患者的海马中表达明显减低。通过构建 GST-TMEM132B 融合蛋白进行 GST-Pulldown 在小鼠海马匀浆液中反向寻找其结合蛋白,并通过质谱学分析发现其能够结合 GABAA 受体亚基系列家族成员。研究人员进一步在小鼠脑组织中进行免疫共沉淀实验中发现 TMEM132B 能够与 GABAA 受体结合。另外,在小鼠中遗传敲除 TMEM132B 会导致 GABAA 受体在突触后膜表达量下降并降低 GABA 能抑制性突触传递。这些结果表明 TMEM132B 蛋白与 GABAA 受体相互作用并调节 GABAA 受体在突触上的含量。
TMEM132B 调节酒精在 GABAA 受体上的正向变构效应
在此之前有许多研究已经显示酒精是 GABAA 受体的正向变构调节剂 2,13-15。因此,作者研究了 TMEM132B 是否能调节酒精在 GABAA 受体上的作用。研究团队首先在表达 GABAA 受体和 TMEM132B 的 HEK293T 细胞中测量了 GABA 诱导的全细胞电流,发现虽然酒精(50 mM)在只表达 GABAA 受体的细胞中增强了非饱和浓度 GABA(10 uM)诱导的全细胞电流,但在表达 GABAA 受体和 TMEM132B 的细胞中,全细胞电流的增强幅度更大(图 1A)。该结果表明 TMEM132B 能增强异源细胞中酒精对 GABAA 受体的正向变构效应。值得注意的是 GABAA 受体的其他结合蛋白,包括 Shisa7、gephyrin、LHFPL4 和 Neuroligin2,并没有增强酒精对 GABAA 受体的正向变构效应,这表明 TMEM132B 在调节酒精对 GABAA 受体的正向变构效应方面具有独特性。另外,在 HEK293T 细胞中的剂量-反应曲线实验显示,TMEM132B 显著增强了酒精在不同浓度下对 GABAA 受体的正向变构效应(图 1B)。然而,TMEM132B 并没有改变酒精对调节 GABA 诱导电流的 EC50(图 1B)。因此,TMEM132B 增加了酒精增强 GABAA 受体电流的功效 (efficacy),但不改变其效力(potency, EC50)。另外,在澳大利亚昆士兰大学 Angelo Keramidas 研究员和陆伟实验室博士后彭世笑的共同协助下,研究人员进一步证明了 TMEM132B 结合 GABAA 受体以后能引起 GABAA 受体离子通道的关闭减慢。这一结果表明 TMEM132B 结合 GABAA 受体除了能增强酒精在 GABAA 受体上的正向变构效应,也能调控 GABAA 受体离子通道的动力学。
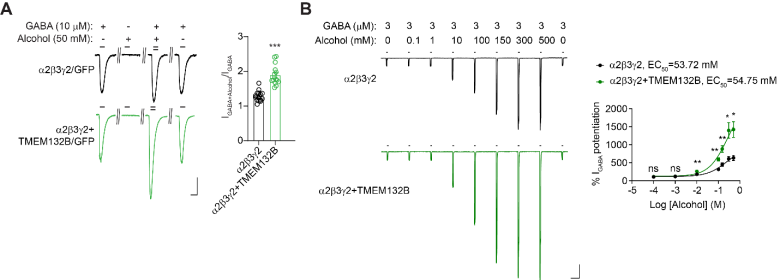
图 1. TMEM132B 增强了酒精在 GABAA 受体上的正向变构效应. (A) 左图:显示了 HEK293T 细胞中 GABA 或 GABA+酒精诱导的全细胞电流。右图:柱状图显示 TMEM132B 增强了酒精在 α2β3γ2 GABAA 受体上的正向变构效应。(B) 左图: 显示了在表达 α2β3γ2 GABAA 受体或 α2β3γ2 GABAA 受体与 TMEM132B 的 HEK293T 细胞中,由 GABA 或 GABA+酒精诱导的全细胞电流。右图:剂量反应曲线显示,TMEM132B 显著提高了酒精增强 GABAA 受体电流的功效 (efficacy),但不影响其效力(potency, EC50)
基因敲除 TMEM132B 导致小鼠饮酒增多并降低酒精的镇定与催眠效应
接下来,研究人员对 TMEM132B 基因敲除小鼠进行系列的和酒精相关的行为学分析。在十字迷宫实验中,当给小鼠注射低剂量酒精(1.5 g/kg)时,相比野生型小鼠,敲除 TMEM132B 的小鼠在十字架开放区活动次数明显减少(图 2A)。这说明基因敲除 TMEM132B 能降低低剂量酒精的抗焦虑效应。当注射高剂量的酒精(4 g/kg)时,研究人员发现敲除 TMEM132B 的小鼠更不容易进入镇定与催眠的状态。比如,在翻正反射丧失(loss of righting reflex, LORR)行为实验中,对比野生型小鼠,TMEM132B 敲除小鼠在注射等剂量的酒精(4 g/kg)后,其达到失去知觉状态时所需的时间更久,另外从失去知觉中苏醒过来所用时间更短(图 2B)。这些结果表明,敲除 TMEM132B 以后会减弱酒精在神经系统中的作用,降低酒精的镇定和催眠的功效。另外,研究人员也设计了长期饮酒和酗酒实验,并观察到敲除 TMEM132B 的小鼠在训练饮酒一周左右,饮酒量明显增加,超过了同窝野生型对照小鼠。最后,研究人员在小鼠酗酒实验中发现敲除 TMEM132B 的小鼠有更严重的酗酒行为。
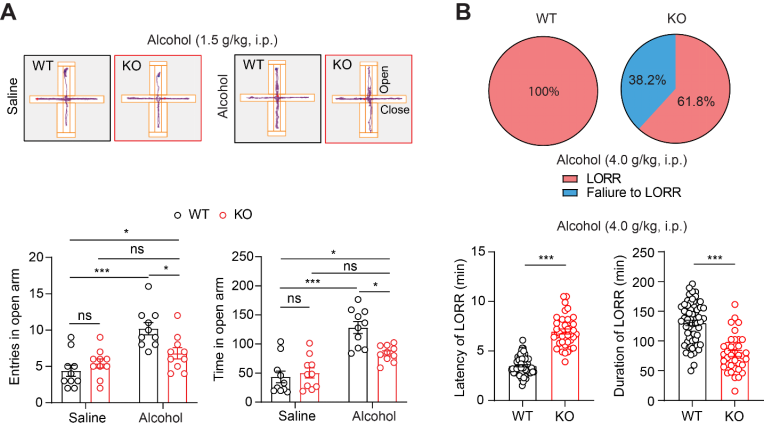
图 2. TMEM132B KO 减弱了酒精的抗焦虑和催眠作用。(A) 上图:高架十字迷宫(EPM)中小鼠在臂中的代表性累计运动图。低剂量酒精(1.5 g/kg)增加了 WT 小鼠在 EPM 开放臂中的停留时间和进入开放臂的次数(下图),但对 KO 小鼠无效。(B) 饼图显示高剂量酒精(4.0 g/kg)导致所有 WT 小鼠出现 LORR,而仅约 62% 的 KO 小鼠出现 LORR(上图)。另外,在出现 LORR 的 TMEM132B KO 小鼠里,注射酒精(4.0 g/kg)引起的 LORR 潜伏期显著延长了, 同时 LORR 持续时间也显著缩短了(下图)
目前,虽然酒精能结合并调控大脑中多种离子通道和受体,但科学界对酒精是怎么引起各种行为反应的分子机制的了解并不深入。当前的研究结果表明,一个新的跨膜蛋白 TMEM132B 能调节酒精在 GABAA 受体上的功能,并能抑制小鼠的饮酒行为和增强酒精的降焦虑,镇定和催眠功能。当然,这项研究也不排除谷氨酸 NMDA 受体或其它受体和离子通道在调节酒精的行为效应上的重要功能。另外,酒精的行为效应也与多巴胺神经元的活性有关,但是酒精如何调控多巴胺神经元释放多巴胺还需要深入研究。
美国国立卫生研究院国家神经疾病与中风研究所陆伟研究员是本文的通讯作者,课题组博士后王国昊,彭世笑,吴坤伟,Miriam Reyes Mendez,韩文妍,David Castellano, 实验室管理员田庆君老师,澳大利亚昆士兰大学 Angelo Keramidas 研究员,国家神经疾病与中风研究所蛋白质谱学中心的 Yan Li 博士,国家眼科研究所的 Lijin Dong 博士,NINDS& NICHD 动物中心员工 Daniel Abebe 等,在该研究中都做了重要贡献。