
来源《中国新药杂志》2023年第32卷第2期
作者国家药品监督管理局药品审评中心陈淼,任连杰
摘要
本文对国内外有关化学药品贮藏条件的法规指南、现行药典进行调研和对比分析,结合已上市药品贮藏条件表述存在的问题,提出化学药品贮藏条件制定的考虑与建议,以期为化学药品贮藏条件规范化提供参考。
关键词化学药品; 贮藏条件; 稳定性研究; 制定; 规范
正文
药品稳定性除与自身结构、理化性质及处方工艺有关外,与药品包装容器和贮藏条件也有很大关系,如温度、湿度、光照、空气中氧气和微生物等,不当的贮藏条件对药品质量有很大影响,进而影响药品的安全性和有效性。本文通过检索国内外法规指南、药典规定等对化学药品贮藏条件要求进行对比分析,并结合贮藏条件表述存在的问题提出化学药品贮藏条件制定的考虑与建议,供同行参考。
1国内法规和技术指南
我国关于贮藏条件的法规及技术指南涵盖药品研发、注册及上市后流通等药品全生命周期。
国家药品监督管理局于2015年发布的《化学药品原料药和制剂稳定性研究指导原则》[1]中规定,应基于对稳定性信息的全面评估制定贮藏条件,对不能冷冻的药品应有特殊的说明,避免使用如“环境条件”或“室温”等不确切的表述。
《药品说明书和标签管理规定》(局令第24号)及其规范细则[2-4]、《化学药品及生物制品说明书通用格式和撰写指南》[5]中规定,【贮藏】项下“具体条件的表示方法按《中华人民共和国药典》要求书写,并注明具体温度,如: 阴凉处(不超过20℃)保存。”
《药品经营质量管理规范》2016年版[6]中规定,按包装标示的温度要求储存药品,包装上没有标示具体温度的,按照《中华人民共和国药典》规定的贮藏要求进行储存; 储存药品的相对湿度为35%~75%; 强化冷链管理,加强冷藏、冷冻药品温湿度的控制和设施设备要求,确保全过程冷链。
我国关于贮藏条件的法规及技术指南对不同阶段药品贮藏条件的制定和管理具有指导作用,但涉及内容较为概括,对具体药品的贮藏条件制定和规范撰写指导作用有限。
文章内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明【来源:凡默谷公众号】。
2国外法规和技术指南
2.1 美国法规和技术指南
美国联邦法规21CFR
Sec.201规定了处方药和非处方药说明书及标签内容和格式要求。其中处方药专业医师药品说明书中在“16如何供应/贮藏和处理”项下规定,应描述“特殊处理和贮藏条件”; 患者说明书如患者信息(patient information)、用药指导(medication guides)或使用说明(instruction for
use)等在不同位置均有“我该如何储藏药品”的相关描述,且不同形式患者说明书在相关描述项下均增加了“将药品放置在儿童接触不到的地方”的描述。非处方药说明书在“其他信息”项下提供贮藏要求,并在“警告”项下有“放在儿童接触不到的地方”的描述,该描述有时可省略。
《药品标签中儿童防开启包装声明》[7]中规定,如果使用了儿童防开启包装,应在说明书及标签中明确,处方药说明书在“16如何供应/贮藏和处理”和“我该如何储藏药品”项下写明,非处方药建议与贮藏条件一并写在“其他信息”项下。
2.2 欧洲法规和技术指南


2.3 日本法规和技术指南
日本发布了《处方药说明书记载要点》[11]以及《处方药说明书记载要点注意事项》[14]、《非处方药说明书记载要点》[15]以及《非处方药说明书记载要点注意事项》[16]等指南,其中对贮藏条件均有不同程度的规定。处方药说明书中应该包括长期贮藏条件以及开封后暂存条件,并记载“应存放在儿童接触不到的地方”等相关描述。非处方药说明书中对贮藏条件没有特殊要求。
美国和日本针对化学药品稳定性研究的指南较为简略,主要针对说明书中贮藏条件的撰写提出要求。欧盟《贮藏条件声明的指南》和《无菌药品开启后有效期指南》详细描述了药品贮藏条件该如何撰写并提供了贮藏条件推荐的描述,对药品贮藏条件的制定与规范撰写具有实际的指导意义。
3ICH/WHO国际组织相关技术指南
3.1 WHO技术指南
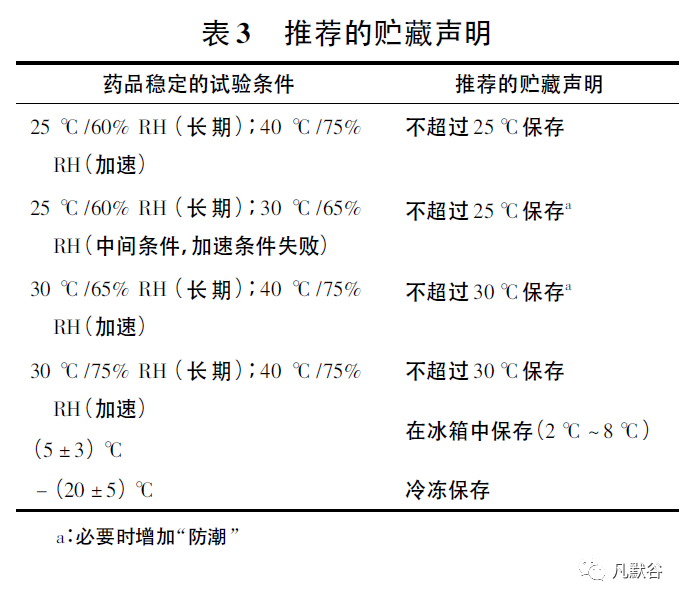
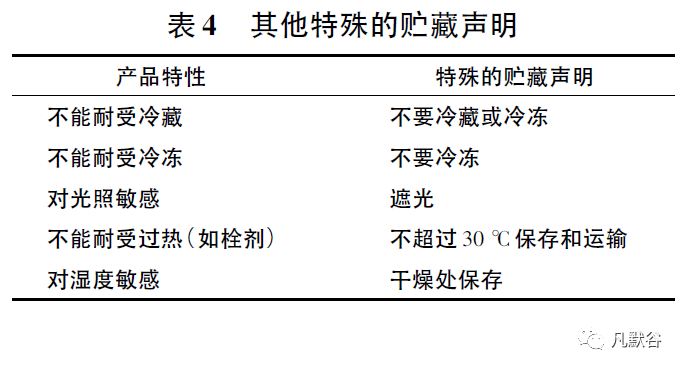
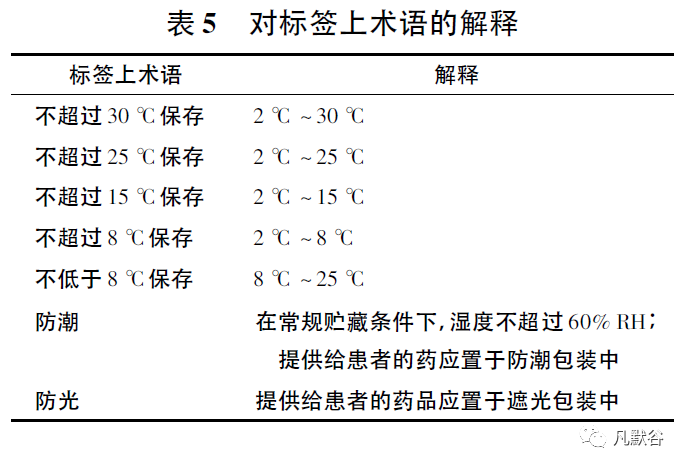
2003年发布了《良好的药品贮藏规范指南》[19],对药品贮藏环境、温度监测、文件记录等有明确规定,同时对贮藏条件术语进行了解释,如“常规贮藏条件”指在干燥、通风处保存,温度为15℃~25℃,或根据气候带不同,最高温度为30℃,无异味、其他污染和强光照射; 其他标签中贮藏条件术语解释见表5。
WHO为全球性组织,其制定的稳定性指导原则综合考虑全球不同的气候与条件。处于气候带III(干热带)和气候带IV(湿热带)的国家和地区不属于ICH区域范畴,这些国家和地区可根据WHO稳定性指南定义长期稳定性试验条件,如30℃/75%RH。由于WHO涉及的国家及区域广泛,因此制定《贮藏条件声明的指南》时严格根据长期稳定性试验条件确定药品的贮藏条件并注明具体温度,以避免含糊不清的贮藏条件描述使得同一药品在不同气候带上市销售时因不当贮藏引起安全性风险。
3.2 ICH技术指南
我国已加入ICH,在药品的研究与评价方面应遵循ICH三方协调指导原则。ICH Q1A~1E为新原料药和制剂的稳定性试验指导原则,Q1A中提供了一般情况(25℃/60%RH或30℃/65%RH)、拟冷藏(5±3)℃、拟冷冻-(20±5)℃贮藏药物的稳定性试验条件,Q1B中提供了光稳定试验条件,选择的试验条件和研究时长应充分考虑贮藏、运输和使用的整个过程,根据稳定性试验结果确定药物的贮藏条件。
4各国药典对比
各国药典概论部分均收载有贮藏条件的表述,主要涵盖光照、包装状态和温度,美国药典还对“干燥处”进行了阐述。但具体到某一维度,各国药典的具体规定尚存在一定差异。如贮藏温度(见表6),各国药典收载情况并不相同。

各药典收载的包装状态也不尽相同,《中华人民共和国药典》、欧洲药典和日本药典均是列举了几个术语解释,如《中华人民共和国药典》包含“密封”、“密闭”、“严封”等,欧洲药典有“In an airtight container”,日本药典包含“A
well-closed container”,“A tight container”,“A hermetic container”; 而美国药典则包含了较为全面的包装类型和定义,如儿童防开启包装(child-re-sistant packaging)、老年人友好型包装(senior-friendly
packaging)、密闭/密封包装(tight
container/well-closed container)、遮光包装(light-resistant
container)等,并包含了注射剂包装、非注射剂包装、医用气体包装等包装类型。仅美国药典中对“干燥处(dry place)”有规定,指“在20℃下或其他温度的等效水蒸气压力下,平均相对湿度不超过40%; 将药品贮藏在经验证防潮的容器中,也可被认为是干燥处”,其他国家药典中均未见相关规定。
《中华人民共和国药典》凡例中收载的贮藏条件较为有限,贮藏温度仅包括“冷处、阴凉处和常温(室温)”,缺少“冷冻”,同时缺少对于“干燥处”或湿度的定义等。相比而言,美国药典〈659〉对于包装状态和贮藏条件的阐述则较为全面。除此之外,美国药典〈659〉和〈1072〉还对药品贮藏过程中温度短暂偏移进行了阐述与规定,更贴合药品长期贮藏过程的实际情况。
5审评建议与思考
5.1 我国化学药品贮藏条件存在的问题
5.1.1 法规和技术指南方面
从前文国内外法规和技术指南对比可知,我国关于贮藏条件的法规指南涵盖范围较为广泛,包括药品研发、注册及上市后流通,体现出药品贮藏条件在药品全生命周期管理中的重要性。但法规和技术指南的详细程度尚不如欧美国家,例如: 指导药品研发过程中根据药品稳定性研究数据合理制定、规范撰写药品贮藏条件方面的技术指南尚存在空缺; 避免儿童触及的特殊贮藏要求仅在非处方药【注意事项】中略有提及,但处方药相关的法规和技术指南中并没有相关规定。通过对比国内外法规和技术指南,提示我国关于药品贮藏条件的法规和技术指南尚需进一步完善。本文撰写期间监管机构正在起草更具针对性的技术指南以指导药品研发企业科学合理地制定药品贮藏条件并规范撰写,相关指南的发布将进一步完善和细化我国药品贮藏条件相关法规和技术指南体系的建设。
5.1.2 药典方面
《中华人民共和国药典》凡例中收载了包括光照、包装状态和温度3个维度的贮藏条件,但包含内容较为有限,且与主流国家药典中收载贮藏条件以及ICH Q1推荐的稳定性条件不一致、不匹配,例如: 缺少“冷冻”条件; “冷处”温度范围为“2℃~10℃”,与ICH Q1推荐的冷藏长期稳定性条件(5±3)℃不匹配; 阴凉条件没有温度下限; 缺少对“干燥处”的解释等。建议国家药典委员会进一步完善《中华人民共和国药典》凡例中贮藏相关规定,如增加“冷冻”等贮藏温度要求,以“冷藏”替换掉“冷处”,与主流国家药典及ICH指南统一,同时建议“阴凉处”增加温度下限控制、增加“干燥处”解释说明等。
5.1.3 化学药品贮藏条件制定与规范撰写存在的问题
我国化学药品贮藏条件制定与规范撰写方面尚存在一定问题,主要包括: ①贮藏条件表述不规范: 贮藏温度表述不规范,如在“4℃以下保存”、“低温(低于-5℃)保存”等,该类贮藏条件对药品上市后的贮藏与流通挑战很大; 对光照重复要求,如“遮光、在凉暗处保存”等。②同一品种不同厂家贮藏条件不一致[18]:一些早期上市的化学药品,由于不同厂家研发水平差异、不同厂家生产的同一品种处方工艺也不尽相同,导致不同厂家生产的同一品种贮藏条件不一致。如早期多西他赛注射液,不同厂家贮藏条件包括“2℃~8℃,密闭,遮光保存”、“遮光,密闭,在2℃~20℃保存”、“遮光,2℃~25℃保存”等,给临床使用和贮藏造成困扰。伴随仿制药质量和疗效一致性评价工作的推进,该类问题得到了很大程度改善。③同一品种国内外贮藏条件不一致: 由于国内外法规和技术指南、药典中贮藏条件的规定并不完全相同,导致境外品种在境内申报上市时需注意根据稳定性数据和国内贮藏条件要求制定及撰写贮藏条件。④稳定性研究数据不充分: 此问题包含多个方面,如稳定性样品选择不具有代表性、考察指标不全面、试验条件与贮藏条件不匹配等,故不能给药品贮藏条件的制定提供充分可靠的依据。⑤其他: 我国多数药品还缺少儿童防开启或防触及的提醒,导致儿童误服药品事件偶有发生[19]; 也未区分专业说明书和患者说明书,可能导致患者对贮藏条件等理解不到位引起用药安全性风险等。
5.2 化学药品贮藏条件制定基本原则
化学药品贮藏条件应综合药品稳定性试验结果和流通过程中可能遇到的情况进行综合分析。用于支持药品贮藏条件制定的稳定性研究数据应充分准确,结合药品特性并参考ICH Q1和《化学药品原料药和制剂稳定性研究指导原则》设计和开展稳定性试验。涉及特殊贮藏条件的化学药品,应结合具体品种特性开展稳定性研究,确保制定的每一项贮藏要求均有稳定性数据的支持。
仿制药的贮藏条件通常应参照参比制剂制定,不能通过降低贮藏条件以使仿制药质量与参比制剂达成一致。如果参比制剂获批贮藏条件为“不超过30℃保存”,而仿制药必须贮藏在“阴凉处(不超过20℃)”才能在有效期内稳定,恰说明仿制药的质量与参比制剂不一致。这种情况,需要对药品的处方工艺等进一步优化,来确保仿制药与参比制剂质量和疗效一致,而不是简单降低贮藏条件以掩盖质量不一致的事实。
境外已上市药品在国内上市销售时,应特别注意依据稳定性数据确定贮藏条件,不能简单翻译境外获批贮藏条件。如在室温保存或无特殊温度要求的境外已上市药品进口到中国时,不能简单确定贮藏条件为“常温保存”,因为欧美药典中室温(不超过25℃)并不等同于《中华人民共和国药典》中规定的常温(室温,10℃~30℃),此时应根据稳定性试验结果合理制定贮藏条件。
《中华人民共和国药典》收载的药品贮藏温度包括冷处(2℃~10℃)、阴凉处(不高于20℃)和常温(10℃~30℃),与ICH推荐的稳定性试验条件不完全匹配,比如置于阴凉条件下贮藏的药品无对应的ICH推荐长期稳定性试验条件。如有药品确需在阴凉条件下贮藏时,建议在符合GMP要求的条件下开展稳定性研究,并对稳定性试验条件的温湿度进行实时监测和记录,以便做好管理和溯源。
为避免儿童误服,应注明“请将本品放在儿童不能接触的地方”相关描述或使用儿童防开启包装。
5.3 化学药品贮藏条件书写规范
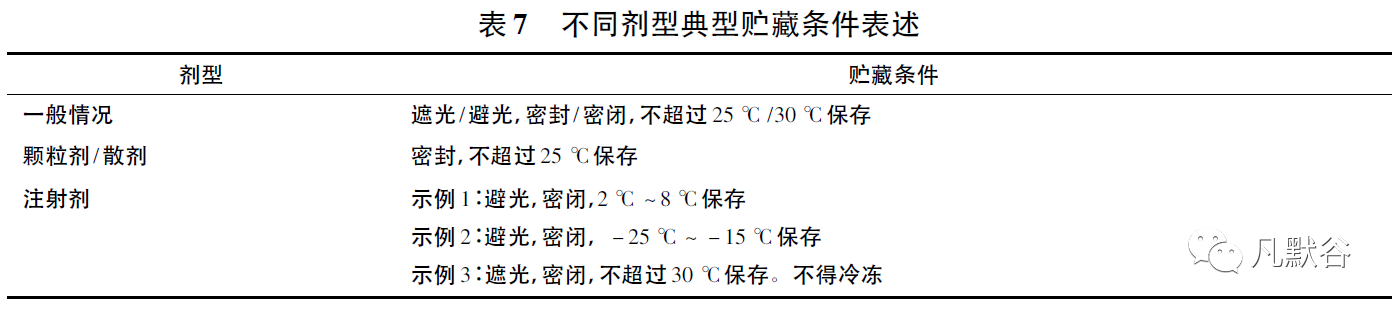

如涉及药品使用过程中的暂存,包括多剂量药品开启后保存、药品稀释配伍后、给药装置装载药品后等,需要开展相应使用中稳定性研究,并根据研究结果确定暂存条件和允许时限。
6结语
目前我国化学药品贮藏条件在制定和规范撰写方面尚存在一定问题,需要业界与监管界共同努力完善。药品上市许可持有人作为药品的第一责任人,应根据准确规范的研究结果科学制定药品贮藏条件,并进行全生命周期管理。建议监管机构进一步完善和细化我国药品贮藏条件相关的法规和技术指南体系建设,同时建议国家药典委员会进一步完善《中华人民共和国药典》凡例中贮藏相关规定,加强与主流国家药典的协调。伴随我国药品说明书和标签管理不断完善和规范,建议区分专业说明书和患者说明书,在患者说明书中使用通俗易懂的文字描述贮藏条件等。正确做好药品贮藏管理工作,保证药品质量,能够有效防止潜在贮藏相关用药风险的发生,进而保证人民群众用药安全。
参考文献
详见《中国新药杂志》2023年第32卷第2期