
药明康德内容团队编辑
今天,作为国际合作试点项目Orbis的一部分,美国FDA批准Seattle Genetics公司开发的HER2特异性抑制剂Tukysa(tucatinib)上市,与曲妥珠单抗和卡培他滨联用,用于治疗手术无法切除或转移性经治晚期HER2阳性乳腺癌成人患者。FDA发布的公告表示,这一批准是FDA在Orbis项目下首次批准的新分子实体(NME),FDA也在这一项目中首次与新加坡和瑞士的监管机构进行了合作。Tukysa的新药申请从获得优先审评资格到获得批准只花了两个月的时间,比预定时间提前了4个月!

HER2阳性乳腺癌约占乳腺癌患者总数的1/5,这些肿瘤过度表达人类表皮生长因子受体2(HER2),这种蛋白会促进癌细胞的生长。超过25%的转移性HER2阳性乳腺癌女性患者会发生脑转移。
Tukysa是一种口服酪氨酸激酶抑制剂,对HER2具有高度特异性,但对同属人表皮生长因子受体家族的EGFR没有明显抑制作用。以往的研究显示,不论是作为单一疗法还是与化疗和其他HER2靶向药物联合使用,它都显示出抗癌活性。此前,它曾经获得FDA授予的快速通道资格、孤儿药资格和突破性疗法认定。
Tukysa的批准是基于一项纳入612例HER2阳性晚期不可切除或转移性乳腺癌患者的临床试验结果,这些患者既往接受过曲妥珠单抗、帕妥珠单抗和抗体偶联药物Kadcyla的治疗,48%的入组患者在试验开始时出现脑转移。
试验结果表明,接受Tukysa、曲妥珠单抗和卡培他滨治疗的患者的中位无进展生存期(PFS)为7.8个月,而接受安慰剂、曲妥珠单抗和卡培他滨治疗的患者为5.6个月。接受Tukysa组合疗法治疗的患者的中位总生存期(OS)为21.9个月,对照组这一数值为17.4个月。

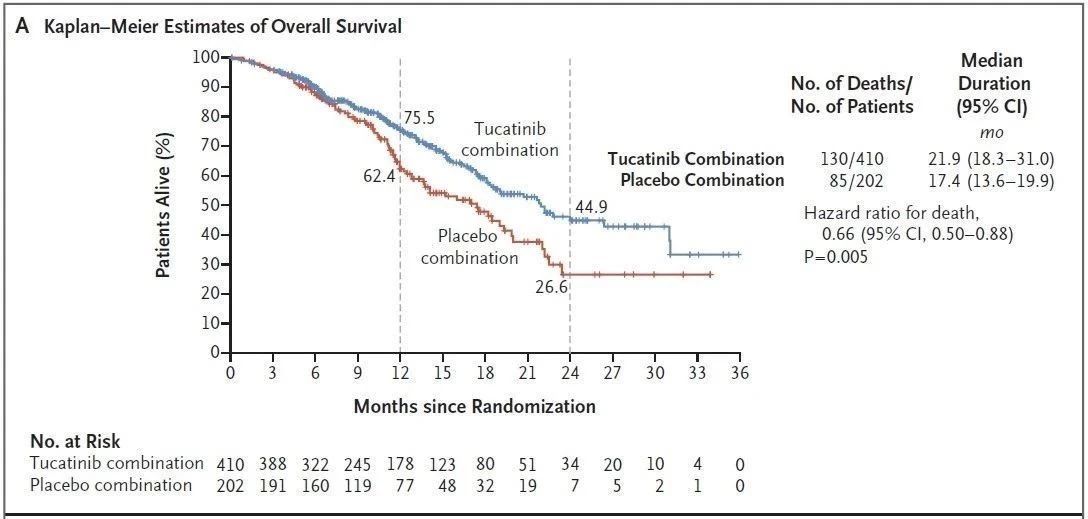
▲Tukysa三联疗法的PFS(上图)和OS数据(下图)(图片来源:参考资料[2])
FDA与澳大利亚、加拿大、新加坡和瑞士的监管机构就此次审评进行了合作。虽然FDA今天批准了Tukysa,但该申请仍在其他机构的审评中。国际监管机构之间的合作有望允许癌症患者更早地获得其他国家的产品。新疗法的尽早上市和成为全球标准治疗可能会对越来越国际化的癌症临床试验进行产生影响,并可能加速抗癌产品的开发。通过同步提交和审评肿瘤药物的框架,Orbis项目促进了审评过程中不同团队的合作,从而帮助发现审评团队之间的任何监管分歧,有助于未来建立更为一致的审评标准。

"FDA的Orbis项目为在FDA的国际合作者之间同时提交肿瘤药物申请和审评提供了框架。我们很高兴第一次与新加坡和瑞士的同事合作,并继续与澳大利亚和加拿大的同事合作,为患者提供新的治疗选择——就像今天Orbis项目下的第一个新分子实体,”FDA卓越肿瘤中心主任、FDA药物评估和研究中心肿瘤疾病办公室代理主任Richard Pazdur博士说。"此次批准代表了HER2阳性乳腺癌患者的额外靶向治疗选择。支持该批准的临床试验除了入组总患者群外,还招募并专门研究了脑转移患者,并且证明了该亚组也能获益。”
参考资料:
[1] FDA Approves First New Drug Under International Collaboration, A Treatment Option for Patients with HER2-Positive Metastatic Breast Cancer. Retrieved April 17, 2020, from https://www.fda.gov/news-events/press-announcements/fda-approves-first-new-drug-under-international-collaboration-treatment-option-patients-her2
[2] Murthy et al., Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. The New England Journal of Medicine, DOI: 10.1056/NEJMoa1914609
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,谢转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。