
本文由药明康德内容团队编辑
拯救脱发!礼来JAK抑制剂获FDA突破性疗法认定
礼来(Eli Lilly and Company)和Incyte公司联合宣布,美国FDA已授予其JAK抑制剂baricitinib突破性疗法认定,治疗斑秃(alopecia areata)患者。新闻稿指出,baricitinib有潜力成为首款FDA批准治疗斑秃患者的疗法。

Baricitinib是一款每日一次的口服JAK抑制剂,它已经获得美国FDA的批准,治疗对TNF抑制剂疗法反应不足的中重度活动性类风湿性关节炎患者。JAK蛋白激酶家族包括JAK1、JAK2、JAK3和TYK2四个成员。它们在介导炎症性细胞因子的信号传递方面起到重要作用。
该突破性疗法的认定是基于名为BRAVE-AA1的2/3期临床研究的积极数据,该研究评估了baricitinib治疗斑秃患者的疗效与安全性。在该项试验的2期试验部分没有发现新的安全性问题。基于它的中期数据,该试验的3期试验部分和一项附加的3期试验目前正在进行中。
小细胞肺癌添“劲敌”!Imfinzi组合疗法提高患者总生存期
阿斯利康(AstraZeneca)公司宣布,其免疫疗法Imfinzi(durvalumab),结合标准护理方法,在一线治疗广泛期小细胞肺癌(ES-SCLC)患者的3期临床试验CASPIAN的最终分析中,显示出对患者总生存期(OS)持续显著的改善。
Imfinzi是一款人源化抗PD-L1单克隆抗体,它通过防止PD-L1与PD-1和CD80受体的结合,解除免疫抑制,增强人体免疫系统对抗癌症的能力。它已经获得FDA批准,治疗经治晚期膀胱癌患者,和经治3级(stage 3)无法切除的非小细胞肺癌(NSCLC)患者。Imfinzi与化疗构成的组合疗法治疗广泛期SCLC患者的补充生物制品许可申请已经获得美国FDA授予的优先审评资格,有望在今年第一季度获得批准。

在名为CASPIAN的开放标签、随机、全球性3期临床试验中,广泛期SCLC患者接受了基于Imfinzi的组合疗法或者标准化疗组合的治疗。Imfinzi组合疗法包括:Imfinzi+依托泊苷(etoposide)+铂基化疗选择(顺铂或卡铂),或者Imfinzi+tremelimumab(抗CTLA-4抗体)+化疗。该试验结果显示,Imfinzi的组合疗法可以使患者得到具有临床意义的总生存期改善。添加了抗CTLA-4抗体的组合疗法没有达到试验的主要终点。该试验的详细数据将在未来的医学会议上公布。
慢性咳嗽不用愁!默沙东P2X3受体拮抗剂达到3期试验终点
默沙东(MSD)公司宣布,其口服选择性P2X3受体拮抗剂gefapixant(MK-7264),在治疗顽固性或无法解释的慢性咳嗽成人患者的两项关键性3期临床试验COUGH-1和COUGH-2中,达到主要疗效终点。与安慰剂相比,gefapixant的治疗显著减少患者的咳嗽频率。
Gefapixant是一种口服选择性P2X3受体拮抗剂。P2X3受体的过度活化与感觉神经元的超敏化(hyper-sensitization)有关。损伤或感染引发的气道和肺部神经元超敏反应可引起过度、持续和频繁的咳嗽。
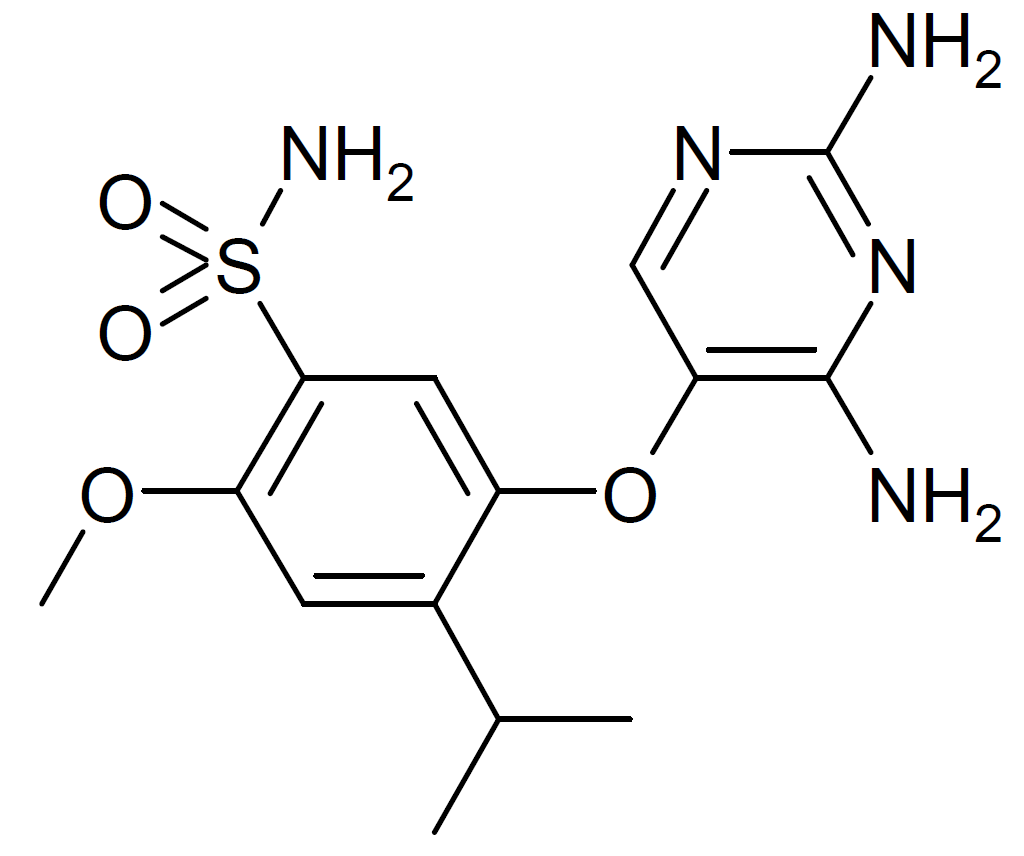
▲Gefapixant分子结构式(图片来源:Meodipt / Public domain)
COUGH-1和COUGH-2是两项随机、双盲、含安慰剂对照组的3期临床研究,旨在评估gefapixant降低难治性或无法解释的慢性咳嗽成人患者咳嗽频率的有效性和安全性。共有732名和1317名患者分别参与这两项研究。其主要研究终点是在第12周和第24周,使用动态数字录音设备评估的24小时内咳嗽频率。试验结果显示,与安慰剂组相比,治疗组中患者的咳嗽频率达到统计学意义上的显著减少,即该试验的主要研究终点。
瞄准“不限癌种”疗法!辉瑞联手IDEAYA
专注于癌症精准治疗的医药公司IDEAYA Biosciences宣布,已与辉瑞(Pfizer)签订一项临床研发合作协议,以评估IDEAYA公司的在研蛋白激酶C(PKC)小分子抑制剂IDE196和辉瑞的MEK抑制剂binimetinib联用,治疗携带GNAQ或GNA11基因突变的实体瘤患者中的疗效,其中包括转移性葡萄膜黑色素瘤(MUM)、皮肤黑色素瘤和结直肠癌(CRC)患者。
IDEAYA公司研发的IDE196是靶向PKC的小分子抑制剂。PKC蛋白激酶家族,位于MEK/MAPK信号通路的上游,G蛋白信号通路的下游。PKC参与影响细胞增殖或转录调节的信号传导。无论是上游的GNAQ或GNA11的基因突变,还是PRKC基因融合,都可导致PKC被持续性激活,从而诱发癌症。
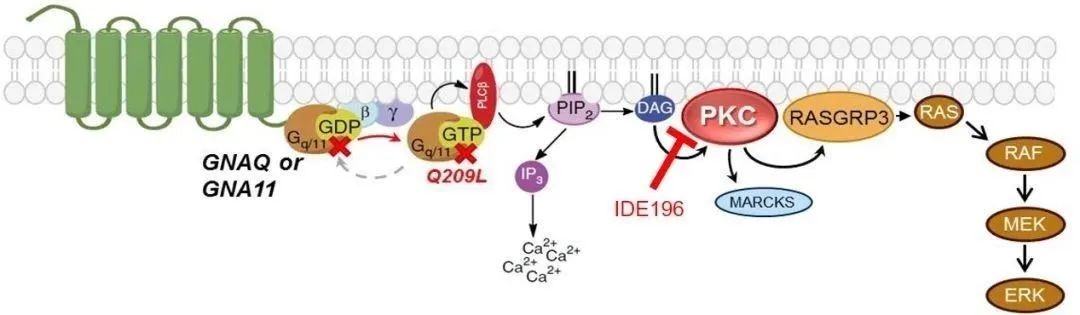
▲IDE196的药物机理示意图(图片来源:IDEAYA官网)
IDEAYA和辉瑞将组成一个联合开发委员会(JDC),双方将就临床试验结果进行联合决策和数据共享。IDEAYA将赞助这项研究,辉瑞公司将为该研究提供binimetinib。该研究将评估通过在上游PKC和下游MEK两个结点处抑制MAP激酶信号通路治疗携带GNAQ或GNA11基因突变的实体瘤患者的缓解率、疗效和持久性。此外,该临床试验还将研究每种药物的药代动力学和联合用药的耐受性。预计该试验将在2020年中期开始。
“亮剑”多系统萎缩!口服MPO抑制剂获快速通道资格
Biohaven Pharmaceuticals公司宣布,其口服髓过氧化物酶(MPO)抑制剂verdiperstat(BHV-3241)已获得美国FDA授予的快速通道资格,用于治疗多系统萎缩(MSA)患者。
MPO是氧化和炎症过程的关键驱动因素,它在一系列脑部疾病中显著增加。抑制MPO的活性是治疗神经炎症和神经退行性疾病(包括MSA)的一种颇具前景的策略。研究发现,MPO水平升高与多发性硬化症和阿尔茨海默病也有关联。Verdiperstat正是一款在研口服MPO抑制剂,Biohaven公司于2018年从阿斯利康(AstraZeneca)公司获得该药物的研发许可。该药物目前已获得美国FDA和欧洲药品管理局授予的孤儿药资格。
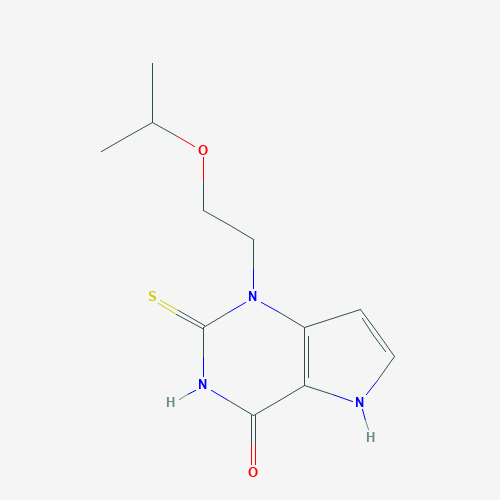
▲Verdiperstat分子结构式(图片来源:PubChem)
此前的2a期临床试验初步结果显示,通过统一MSA评定量表测量的主要疗效结果有所改善。经过12周的治疗后,安慰剂组患者评分下降了4.6分,而使用每日两次300 mg BHV3241的患者分数下降了3.7分,使用每日两次600 mg BHV3241的患者分数下降了2.6分。其他测量结果(比如综合自主症状评分和MSA生活质量量表)也得到相应的改善。这些临床发现与在动物模型中观察到的verdiperstat的神经保护作用一致。Verdiperstat显著降低了人体血液中的MPO活性,这是该药物与其靶标结合的生物标志物。目前,该药物正在一项3期临床试验中评估其疗效与安全性。
阻击肺炎球菌感染!辉瑞20价疫苗3期临床数据积极
辉瑞(Pfizer)公司宣布,其在研20价肺炎链球菌偶联(20vPnC)疫苗,在预防由肺炎链球菌感染引起的肺炎和侵袭性疾病的3期临床试验中,对18岁及以上成人显示出与已获批疫苗Prevnar 13相当的安全性和免疫原性。

偶联疫苗(conjugate vaccine)是通过化学方法将多糖或寡糖抗原,偶联到蛋白质载体上。它能够更好地刺激成人与儿童的免疫反应,从而促使B细胞生产IgG抗体。偶联疫苗有望对多种传染性疾病的预防产生重要作用。
辉瑞公司的开发的20vPnC疫苗包括Prevnar 13中含有的13种血清型,与另外7种新血清型。7种新增加的血清型是侵袭性肺炎球菌疾病(IPD)的全球病因,与高病死率、抗生素耐药性和/或脑膜炎的发生相关。此前,美国FDA曾授予20vPnC疫苗快速通道资格和突破性疗法认定。
这项随机、双盲的3期临床研究共有3880名此前未接种过肺炎链球菌疫苗的18岁及以上成人参与。试验结果显示,与Prevnar 13相比,接种20vPnC疫苗一个月后,试验组中60岁及以上成年人的13种血清型均达到了免疫原性的非劣效性标准。与另一种已上市的疫苗PPSV23中含有的七种新血清型相比,接种20vPnC疫苗的60岁及以上成年人中,六种血清型达到了免疫原性的非劣效性标准。18岁至59岁成人与60岁至64岁成人在20种血清型上均达到非劣效性标准。辉瑞公司将在未来公布其对20vPnC疫苗的安全性和免疫原性的全面分析结果。
破解湿疹困扰!辉瑞JAK1抑制剂达到3期临床终点
辉瑞(Pfizer)公司宣布,其口服JAK1抑制剂abrocitinib,在治疗中重度特应性皮炎(AD)成人患者的3期临床试验JADE COMPARE中,达到了主要研究终点。Abrocitinib的治疗使患者的皮肤症状清除率、疾病严重程度,以及瘙痒方面均有所改善。辉瑞公司预计将在今年晚些时候向监管机构递交新药申请。
辉瑞的abrocitinib是一种口服小分子特异性JAK1抑制剂。JAK1抑制剂通过调节多种与特应性皮炎病理相关的细胞因子来控制病情,包括白细胞介素IL-4,IL-13,IL-31和干扰素γ。之前,abrocitinib已经获得美国FDA授予的突破性疗法认定。
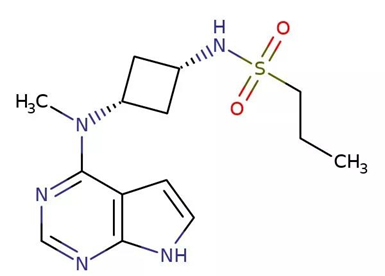
▲Abrocitinib的分子结构式(图片来源:ChemIDplus)
在这项3期临床研究中,中重度特应性皮炎患者在接受外用疗法的同时,接受abrocitinib,活性对照(dupilumab),或安慰剂的治疗。JADE COMPARE研究的结果显示,接受两种不同剂量abrocitinib治疗的患者在第12周达到主要疗效终点的比例,显著优于安慰剂组,这一疗效在第16周得到维持。此外,在治疗的第2周,200毫克abrocitinib治疗组中患者的瘙痒症状得到改善的比例要高于活性对照组,但100毫克abrocitinib治疗组中患者的这一数据未达到统计学意义上的显著改善。该试验的详细数据预计将在未来的医学会议上公布。
里程碑!一月一针长效HIV创新疗法获全球首批
ViiV Healthcare公司宣布,加拿大卫生部(Health Canada)批准该公司开发的长效HIV-1疗法Cabenuva上市,用于在HIV-1病毒已经得到抑制的患者中替代已有的抗病毒治疗方案。Cabenuva是世界上首款只需每月一针,就能有效抑制HIV-1病毒的完整长效治疗方案。它将患者每年接受治疗的天数从365天降为12天。新闻稿指出,这是Cabenuva在全球首次获批。

ViiV Healthcare公司开发的Cabenuva是一款肌肉注射的长效抗病毒疗法。它由两种有效成分构成,分别为利匹韦林(rilpivirine),和卡博特韦(cabotegravir)。利匹韦林是一款口服非核苷逆转录酶抑制剂。卡博特韦是一款整合酶抑制剂,它的作用是抑制病毒DNA整合到人体免疫细胞的基因组中。这一整合步骤是HIV病毒复制过程中不可缺少的一步,也是导致慢性感染的重要原因。
Cabenuva的批准是基于包含16个国家的超过1100名患者的两项关键性3期临床试验的结果。这两项名为ATLAS和FLAIR的临床试验的结果已经在本月发表在《新英格兰医学杂志》(NEJM)上。研究结果表明,每月一次,臀部肌肉注射Cabenuva,与每日服用口服抗病毒疗法相比,治疗48周后,在抑制患者体内HIV-1病毒RNA水平方面效果相当。加拿大卫生部同时还批准了卡博特韦的口服片剂Vocabria,作为接受Cabenuva长效疗法之前的导入疗法。
对参加这两项临床试验的部分患者进行的问卷调查表明,在接受治疗48周之后,回答问卷的532名患者中523名(98%)更倾向于使用Cabenuva,9名(2%)更倾向于使用原先的口服抗病毒疗法,另有59名患者未对问卷做出回答。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。