
2022年4月15日,施维雅公司(SERVIER)宣布,盐酸伊立替康脂质体注射液获得中国国家药品监督管理局(NMPA)正式批准,与5-氟尿嘧啶(5-FU)和亚叶酸(LV)联合用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者。
胰腺癌是一种高度侵袭性的恶性肿瘤,大约一半的患者确诊时已出现转移,30%的患者为局部晚期而无法通过手术治愈,支持治疗、姑息性放化疗、姑息性手术是其重要的治疗策略。胰腺癌因其症状隐匿、恶性程度高、致死率高,也被称为“癌中之王”。目前,化疗仍是晚期胰腺癌治疗的基石,患者治疗药物选择有限,尤其是转移性胰腺癌患者。
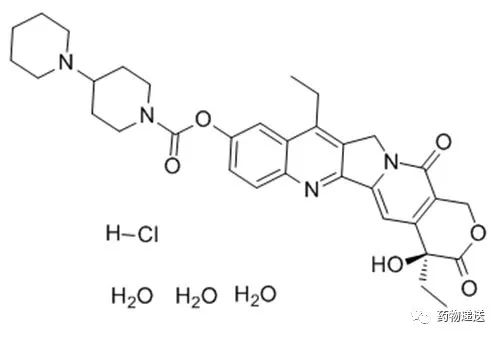
盐酸伊立替康脂质体注射液(Onivyde)是由中国台湾智擎生技制药(PharmaEngine)开发,其商业化道路在HermesBiosci、Merrimack、Baxter、Shire、IPSEN、Servier等多家公司间授权转让,目前分别由中国台湾智擎(中国台湾地区)、Servier公司(欧亚区)及IPSEN公司(美洲区)三家公司持有。
在Onivyde的生产过程中,以葡萄糖溶液溶解活性成分盐酸伊立替康三水合物,随后与空白脂质体混合孵育,通过主动载药方式将药物包载到脂质体内水相,并以伊立替康八硫酸蔗糖盐沉淀的形式存在。Onivyde以脂质体为载体,既解决了伊立替康溶解度低无法注射给药的问题,又提高了伊立替康的安全性和有效性,这个案例对其他喜树碱类药物具有非常重要的借鉴意义。
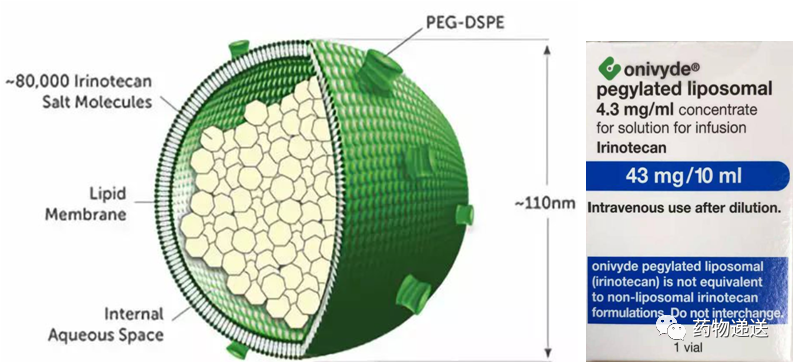
表1 盐酸伊立替康脂质体(Onivyde)获批历程
| 国家/地区 |
获批时间 |
| 美国 |
2015年 |
| 欧洲 |
2016年 |
| 韩国、新加坡 |
2017年 |
| 日本 |
2020年 |
表3 国内伊立替康脂质体进行的临床试验
| 产品名 |
申请人 |
临床进度 |
适应症 |
| 盐酸伊立替康脂质体注射液 |
南京绿叶制药 |
I |
晚期实体肿瘤 |
| II |
小细胞肺癌 |
||
| 四川科伦 |
I |
晚期实体瘤 |
|
| 齐鲁制药 |
I |
实体瘤 |
|
| 恒瑞医药 |
I |
实体瘤 |
|
| III |
胰腺癌 |
||
| 伊立替康脂质体 |
艾昆纬医药 |
III |
铂类药物治疗下/后发生进展的小细胞肺癌 |