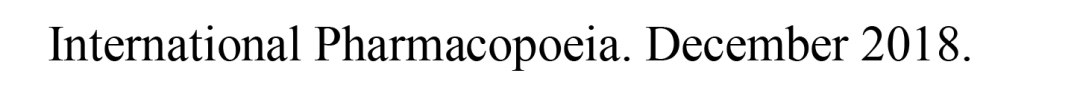1月4日,CDE发布一则“关于《化学仿制药晶型研究技术指导原则(试行)》的通告”(下文简称“指导原则”),对仿制药晶型研究,参比制剂的选择作出了详细的解答。
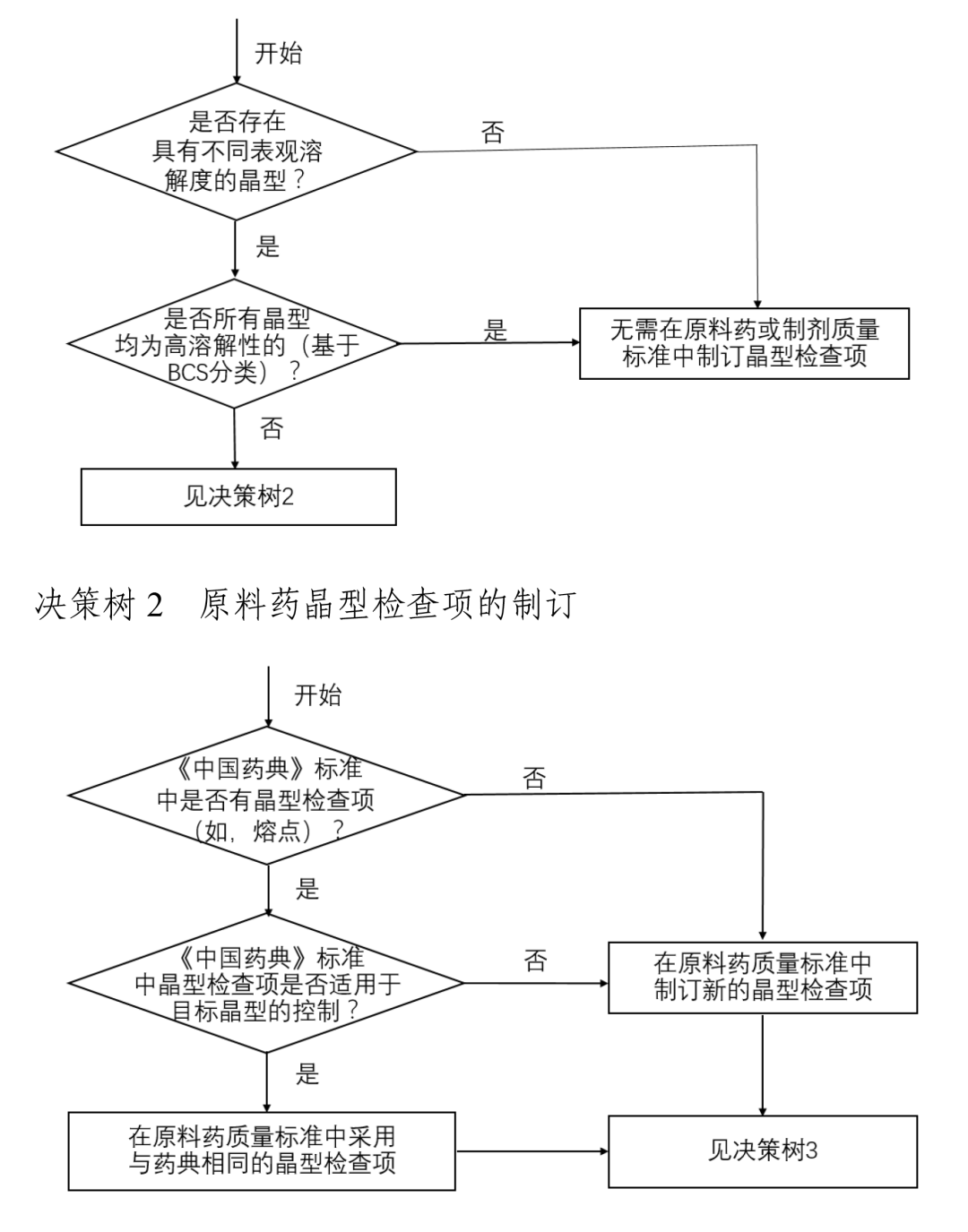
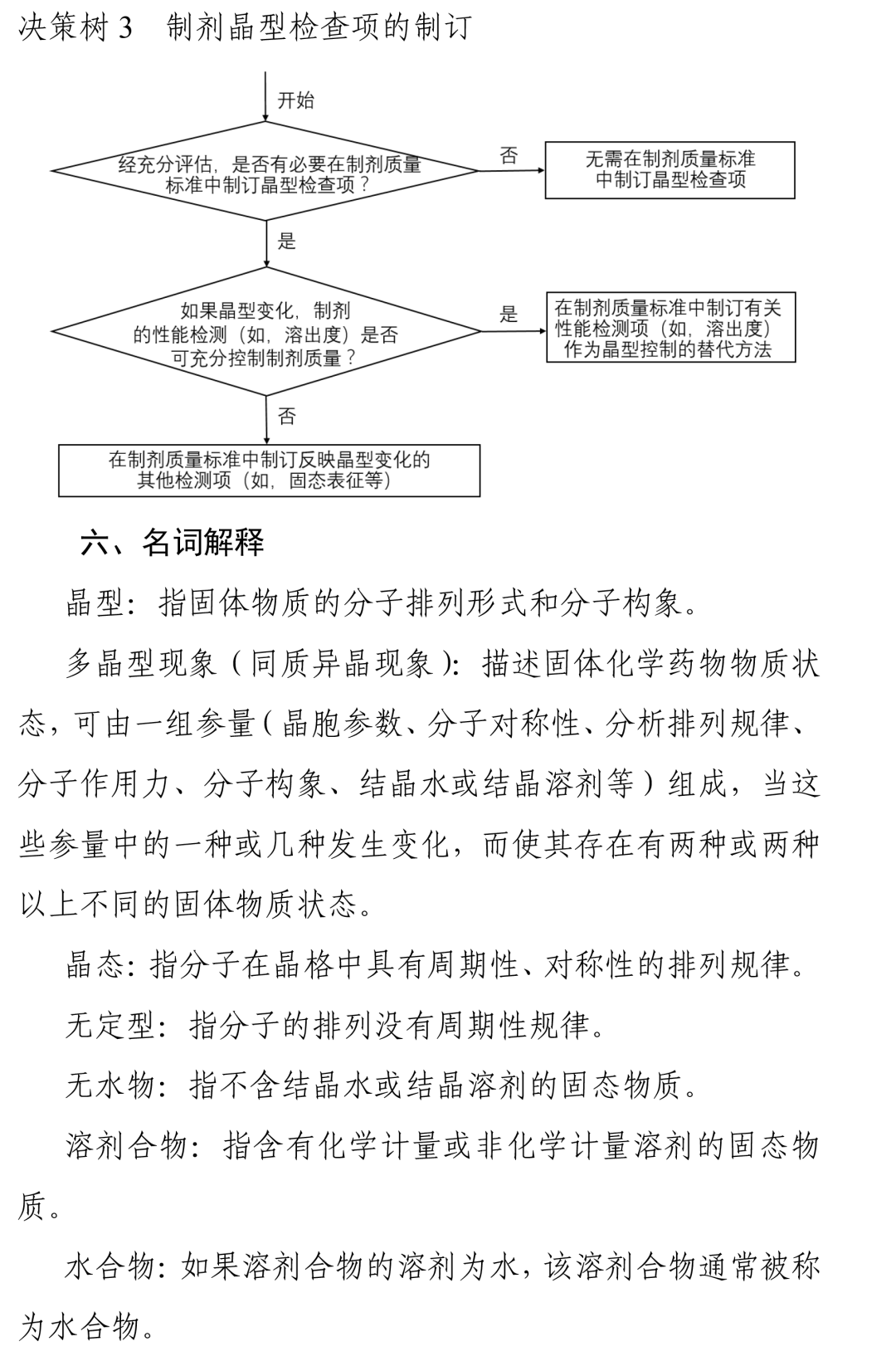
其中,指导原则在仿制药晶型选择中明确了一个重点:对于仿制药,通常情况下应选择与参比制剂一致的晶型。若有足够的稳定性研究数据支持且其他晶型制备的仿制药与参比制剂生物等效,也可选择与参比制剂不同的晶型。无论选择何种晶型,均应对所选择晶型进行充分的理化性质和稳定性研究。
这意味着,晶型的性质和稳定性是研究的关键。
以下是指导原则及其通告全文:

为规范和指导化学仿制药的晶型研究,在国家药品监督管理局的部署下,药审中心组织制定了《化学仿制药晶型研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日(2022年1月4日)起施行。
特此通告。
附件:化学仿制药晶型研究技术指导原则(试行)
国家药监局药审中心
2021年12月23日