
本文由傲骨原创,在“ 佰傲谷BioValley”公众号上发表
近日(3月26日),百时美施贵宝(BMS)宣布FDA批准了ZEPOSIA®(ozanimod)0.92mg用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征(CIS),复发缓解型多发性硬化(RRMS)和继发进展多发性硬化(SPMS)。
ZEPOSIA
ZEPOSIA是一种一日一次的口服药物,是目前唯一一款不需要患者进行基因检测,也不需要首次用药后按照说明进行健康监测的S1PR受体调节剂。
ZEPOSIA(Ozanimod)是一款S1PR受体调节剂,对淋巴细胞表面的S1PR1和S1PR5均有较高的亲和力。
具体而言,当Ozanimod与受体结合后就可以阻止淋巴细胞离开淋巴结进入中枢神经系统,发挥抗炎作用。此外,Ozanimod也能进入中枢神经系统,直接与少突胶质细胞和星形胶质细胞上的S1PR结合,促进髓鞘再生和防止炎症。
此次批准主要基于一项迄今为止最大规模的关键头对头RMS研究——随机,阳性对照III期 SUNBEAM(与干扰素β-1a相比,ZEPOSIA治疗复发性多发性硬化的安全性和有效性)和RADIANCE Part B(选择性S1P受体调节剂ZEPOSIA治疗复发性多发性硬化的安全性和有效性),共有超过2600名患者参加了上述研究。
SUNBEAMSUNBEAM是一项多中心,随机,双盲,双模拟,阳性对照关键III期临床研究,旨在评估口服ZEPOSIA(0.92mg,相当于1mg)相比两年期治疗,每周肌注AVONEX® (interferon beta-1a)的有效性,安全性和耐受性。试验共有来自21个国家150处地点的1320位RMS患者参加。
研究的主要重点是治疗期间的年度复发率(ARR)。次要终点则包括1年内高信号T2加权脑部MRI损伤的增加和增大和钆增强脑部MRI损伤的增多和增大。
最终研究将根据SUNBEAM和RANDIANCE Part B III期临床试验数据,对3月时的确认残疾进展进行预先指定的分析。
RADIANCE
RADIANCE Part B是一项多中心,随机,双盲,双模拟,阳性对照关键III期临床研究,旨在评估口服ZEPOSIA(0.92mg,相当于1mg)相比两年期治疗,每周肌注AVONEX® (interferon beta-1a)的有效性,安全性和耐受性。试验共有来自21个国家150处地点的1320位RMS患者参加。研究的主要重点是2年期的度复发率(ARR)。次要终点则包括2年内高信号T2加权脑部MRI损伤的增加和增大和钆增强脑部MRI损伤的增多和增大。
最终研究将根据SUNBEAM和RANDIANCE Part B III期临床试验数据,对3月时的确认残疾进展进行预先指定的分析。
两项研究中,相比AVONEX®(干扰素β-1a),ZEPOSIA在降低年复发率(ARR)和脑损伤数量及大小方面都有着更好的表现,具体而言:
与AVONEX相比,ZEPOSIA第一年ARR降低了48%,第二年ARR降低38%(绝对ARR分别为0.18 vs 0.35,0.17 vs 0.28)。
第一年时,与AVONEX相比,使用ZEPOSIA治疗减少了63%的T1加权钆增强(GdE)脑部损伤(0.16 vs 0.43)和48%新发或增大的T2脑部损伤(1.47 vs 2.84)。
第二年时,与AVONEX相比,使用ZEPOSIA治疗减少了53%的T1加权钆增强(GdE)脑部损伤(0.18 vs 0.37)和42%新发或增大的T2脑部损伤(1.84 vs 3.18)
安全性方面,两组患者在3月和6月确认残疾进展时没有显示出统计学上的显著差异。
MS药物市场
多发性硬化症(Multiple Sclerosis, MS)是一种严重、终身、进行性、致残性的中枢神经系统脱髓鞘疾病,疾病列入第一批罕见病药物目录。可以分为复发缓解型(RRMS,85%)、原发进展型(PPMS 10%)和进展复发性(PRMS, 罕见型5%)。其中80% RRMS可进展为继发进展型多发性硬化症(SPMS)。
虽然多发性硬化症(MS)虽然属于罕见病,但却坐拥超过200亿美元的庞大市场。
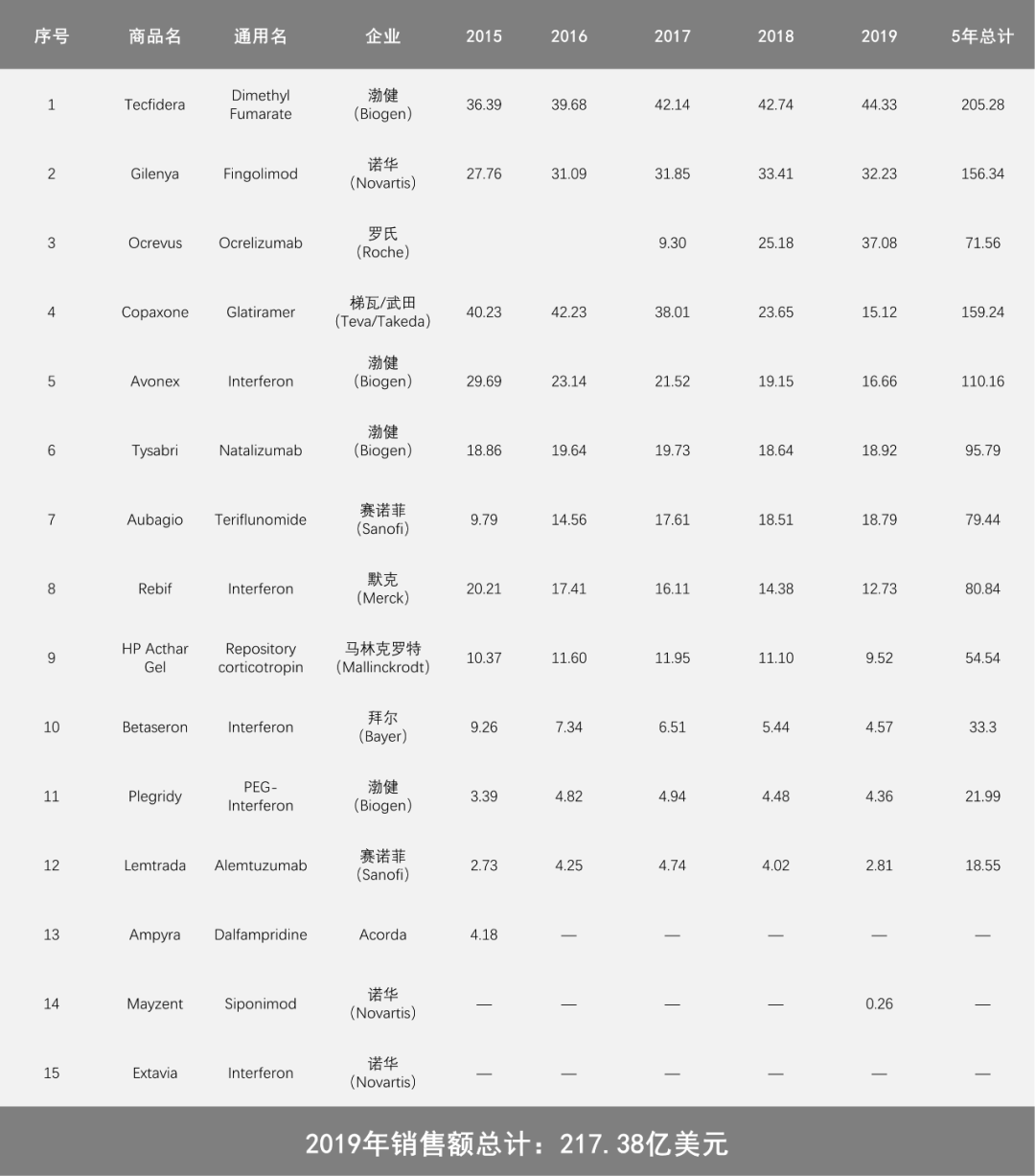
此次BMS获批上市的ZEPOSIA属于S1PR受体调节剂,预计将与其余两款已获批上市的S1P受体调节剂产生直接竞争。ZEPOSIA来自于BMS与新基的并购,曾经经历过上市审批被拒。
2010年9月,诺华旗下S1PR调节剂Gilenya(fingolimod)获批一线治疗MS,作为一款First-in-class的MS治疗药物,极大的减少和缓解了MS的复发和残疾进展。2018年8月,药物适用人群获批扩大到儿童。上市10年来,Gilenya早已进入40亿美元年销售额的超重磅水平,并依然保持着增长势头。
2019年3月,诺华宣布第二款S1PR调节剂——Mayzent(siponimod),获得FDA批准用于复发型多发性硬化症(MS)成人患者的治疗,包括SPMS,RRMS和CIS。截至2019年底,Mayzent共取得2600万美元销售额。
Gilenya定价为60000美元/年,Mayzent定价为88000美元/年。
值得注意的是,2019年12月5日,FDA同日批准3款fingolimod首仿药,分别来自东阳光、Biocon和太阳药业。
近年来,MS领域进展显著。干扰素类产品,例如本次试验中的阳性对照药物AVONEX销售额持续大幅下滑,被依从性和疗效更好的口服类药物以及单抗类药物所取代。
国内MS治疗现状
根据中华医学会神经病学分会发布的《多发性硬化患者生存报告(2018)》,我国已确诊MS患者群体大约有2-3万人。
在我国多发性硬化症患者治疗并不理想,主要体现在治疗药物可及性差,治疗率低,治疗负担重等方面。
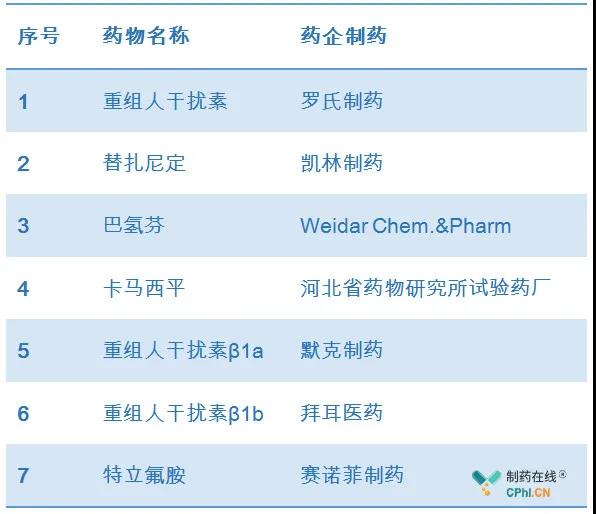
2019年6月,诺华Gilenya(商品名捷灵亚®)在我国获批上市。除此之外,诺华另一款S1PR调节剂Mayzent也于2019年2月递交了上市申请,我国MS患者迎来了更多的疗法选择。此外,根据制药在线CPhi统计,我国市场上还有来自罗氏,拜尔,默克的干扰素类产品和来自赛诺菲的奥巴捷(Aubagio特立氟胺)等。
参考来源:
1. 渤健,诺华,罗氏,赛诺菲,默克,武田马琳克罗特2019年财报
3. 《多发性硬化患者生存报告(2018)》
4. 制药在线CPhi.CN微信公众号