
本文由药渡数据研发团队原创
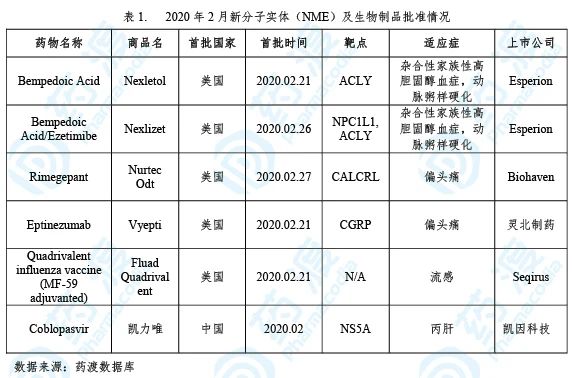
2020年2月,全球首次批准新药主要集中在美国和中国。美国食品药品监督管理局(FDA)批准3个新分子实体药物(NME),用于治疗偏头痛的Rimegepant,治疗杂合性家族性高胆固醇血症和动脉粥样硬化的单药Bempedoic Acid、复方药Bempedoic Acid/Ezetimibe。国家药品监督管理局(NMPA)批准NME药物1个,用于治疗丙肝的Coblopasvir。此外,FDA新批准生物制品2个,分别为治疗偏头痛的Eptinezumab单抗、预防流感的Quadrivalent influenza vaccine(MF-59 adjuvanted)。
01Bempedoic Acid

BempedoicAcid已经于2020年2月21日获得FDA批准,用于治疗杂合性家族性高胆固醇血症(HeFH)、动脉粥样硬化心血管疾病(ASCVD)。该药由Esperion研发上市,商品名为Nexletol®。此外,该公司同期获批了复方降脂药物Bempedoic Acid/Ezetimibe,商品名为Nexlizet® [1,2,3]。
高水平的低密度脂蛋白胆固醇LDL-C可以导致动脉管壁的脂肪和胆固醇沉积,形成动脉粥样硬化,易诱发心脏病和中风等心血管事件。在美国,9600万人或者超过37%的成年人LDL-C水平超标。给予最大剂量的调脂药物后,包括他汀类副反应的个体在内,仍有1800万HeFH病人伴有高水平的LDL-C [4]。对于仅采用他汀类药物方案的ASCVD患者,仍有50%以上的病人无法降低LDL-C[5]。
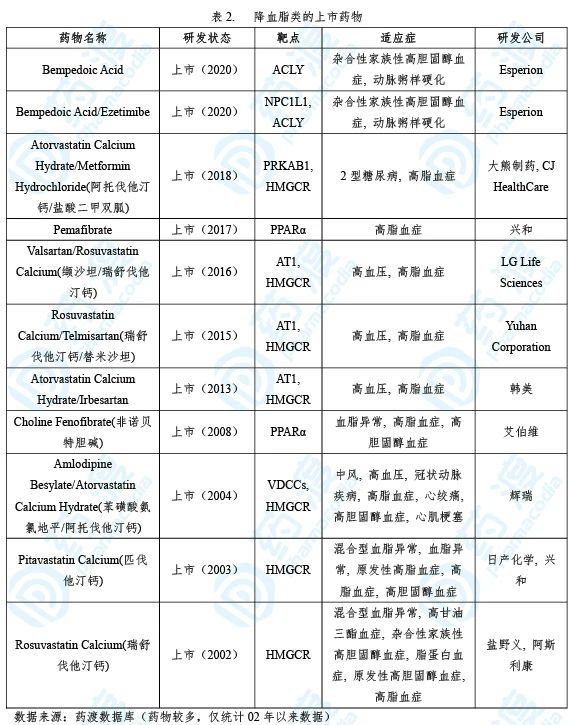
Nexletol®是首个靶向ATP柠檬酸裂解酶(ACL)的抑制剂,通过抑制肝脏的胆固醇合成降低LDL-C水平。
Nexletol®的获批是基于两项关键的全球性临床三期研究,共3000多例病人(试验1,NCT02666664;试验2,NCT02991118)。试验1中,与他汀类药物联用时,Nexletol®组和安慰剂组在12周时相对于基线LDL-C平均变化为-17%、2%,两者差异为-18%(95% CI: -20%,-16%;p<0.001)。试验2中,Nexletol®组和安慰剂组在12周时相对于基线LDL-C平均变化为-15%、2%,两者差异为-17%(95% CI: -21%,-14%;p<0.001)[6]。对于复方药物(NCT03337308),当与最大耐受剂量他汀药物联用时,Nexlizet®组和对照组的LDL-C相比基线变化分别为-36%、2%,两组差异值达-38%(95% CI: -47%,-30%;p<0.001)[7]。
Nexletol®是近20年来首个获批上市的口服、每日单次给药的非他汀类降脂药物。Nexletol® 和Nexlizet®为高LDL-C水平群体提供了更多的用药选择。
02Rimegepant

Rimegepant已经于2020年2月27日获得FDA批准上市,用于治疗成人有或无先兆的偏头痛。该药由Biohaven研发及上市销售,商品名为Nurtec Odt® [8]。
在美国约有4000万偏头痛患者,WHO将偏头痛归为10大致残类疾病。偏头痛表现为持续4~72个小时的发作,常见症状为伴随恶心、呕吐的中高强度的搏动性头痛,并对光、声等敏感。由于发作时严重干扰工作和生活,多数患者需要临床紧急治疗干预[9]。
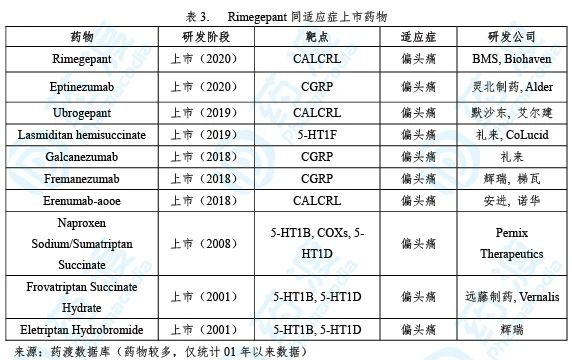
Rimegepant是一种降钙素基因相关肽(CGRP)受体拮抗剂。在偏头痛的病理组织学中,CGRP受体的活化是重要的诱因。临床研究证实,偏头痛发作伴随着血清CGRP水平升高,静注CGRP分子会导致偏头痛患者和非偏头痛个体产生持续性疼痛。因此,靶向CGRP及其受体的拮抗剂是重要的药物开发方向[10]。
Rimegepant获批是基于一项随机、双盲、安慰剂对照试验(NCT03461757),病人分别纳入75 mg Nurtec Odt®治疗组(N=732)、安慰剂组(N=734)。临床疗效指标包括治疗后2小时无痛率、2小时无最烦恼症状MBS。治疗组和安慰剂组的2小时无痛率分别为21.2%、10.9%(p < 0.001),2小时无MBS为35.1%、26.8%(p<0.001)[11]。
Nurtec Odt®为非阿片、非麻醉类药品,不会导致患者产生药物依赖性,对于缓解偏头痛病情更为安全。
03Eptinezumab
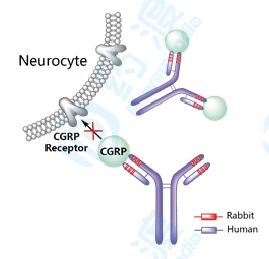
Eptinezumab已经于2020年2月21日获得FDA批准上市,用于成人偏头痛的预防性治疗。该药由Lundbeck研发并上市销售,商品名为VyeptiTM [12]。
Eptinezumab是一种靶向降钙素基因相关肽(CGRP)的人源化IgG1单克隆抗体,可以阻断CGRP与其受体的结合(关于同适应症药物可参考表3)。
VyeptiTM的获批是基于两项随机、多中心、安慰剂对照、6个月双盲的临床试验,分别针对阵发性偏头痛(PROMISE-1,NCT02559895)、慢性偏头痛(PROMISE-2,NCT02974153)。PROMISE-1研究中,在干预1~3个月后,300 mg、100 mg治疗组、安慰剂组的平均月发作次数MMD相对于基线分别为-4.3(p=0.018)、-3.9(p<0.001)、-3.2。PROMISE-2研究中,300 mg、100 mg治疗组、安慰剂组的平均MMD相对于基线分别为-8.2(p<0.001)、-7.7(p<0.001)和-5.6[13,14]。
2018年至今已获批的用于偏头痛的单抗药物有4款,分别为靶向CGRP受体的全人源erenumab,靶向CGRP的人源化fremanezumab(鼠源CDR)、galcanezumab(鼠源CDR)和eptinezumab(兔源CDR)。在偏头痛领域,单抗药物已然成为迅速崛起的后起之秀。
04Quadrivalent influenza vaccine (MF-59 adjuvanted)
Seqirus研发的四价流感疫苗(含MF-59佐剂),已经于2020年2月21日获得FDA批准上市,商品名为Fluad Quadrivalent® [15]。
流行性感冒简称流感,是一种由甲、乙、丙三型流感病毒引起的急性呼吸道传染病。甲型流感病毒常引起世界性大流行,乙型流感为局部暴发,丙型流感以散在形式出现。由于流感病毒经常发生抗原漂移和抗原转换,导致免疫逃逸[16]。根据美国CDC统计,2019年10月以来的流感暴发,已经导致美国3200万人感染,31万住院病例和1.8万死亡(截止2020年2月22日)[17]。WHO认为接种疫苗是最有效的预防措施,而对于感染群体则采取神经氨酸酶抑制剂等对症治疗[18]。

Fluad Quadrivalent ®是一种四价灭活病毒疫苗,含有佐剂MF59C.1成分。该疫苗刺激体液免疫,为易感群体提供免疫保护。
该疫苗的获批是基于一项随机、单盲、非流感疫苗对照、多中心临床三期试验(NCT02587221)。临床免疫学指标为接种21天后血凝抑制滴度大于1:40和血清转换。四价流感疫苗接种组针对A/H1N1病毒株达到1:40滴度为96.2%,A/H3N2为95.6%,B/Yamagata为79.2%,B/Victoria为81.6%;而非流感Boostrix®对照组针对4种毒株的滴度达标率分别为46.7%、41.7%、21.5%和18.4%。流感接种组针对四种毒株的血清转换分别为78.0%、84.6%、60.8%、65.5%,而Boostrix®对照组分别为2.1%、3.9%、3.6%、2.1%[19]。
自2013-2014年北半球流感季节起,WHO建议在三价疫苗(2种甲流亚型、1种乙流亚型)的基础上添加第四种抗原成分,支持开发四价疫苗。目前,由于四价疫苗能够提供更广泛的免疫范围,四价疫苗成为研发热点。国内的华兰、江苏金迪克已推出上市产品。国际上,Seqirus专注于流感病毒疫苗领域,是全球的行业标杆。Fluad Quadrivalent ®作为首个含有佐剂的四价疫苗,可以为易感群体提供更持久的免疫保护。
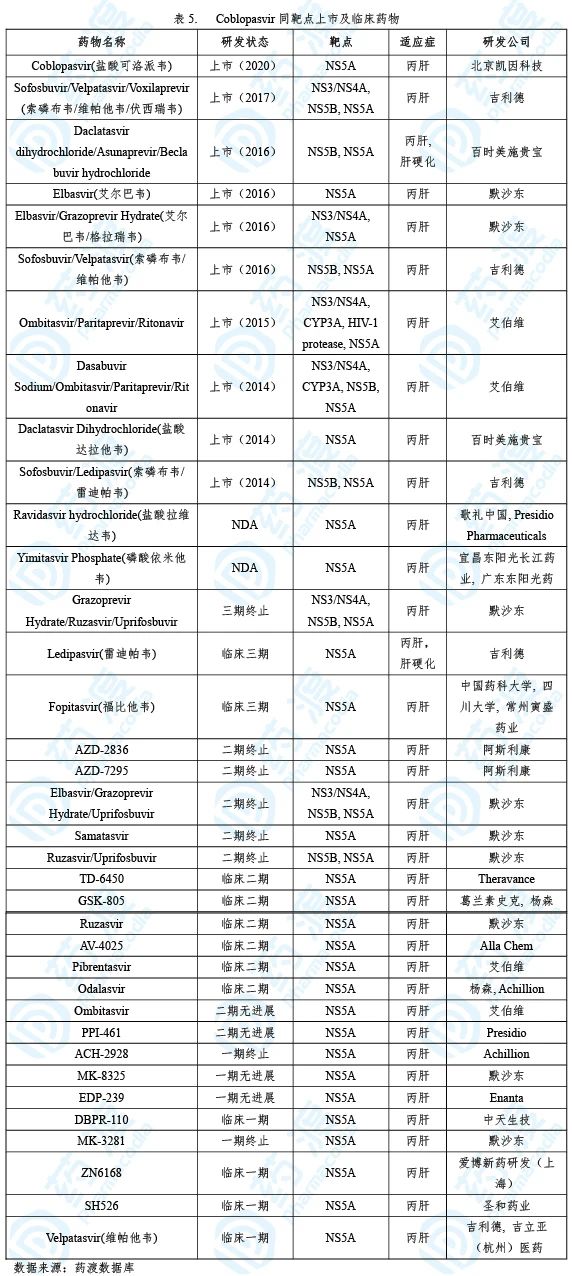
05Coblopasvir
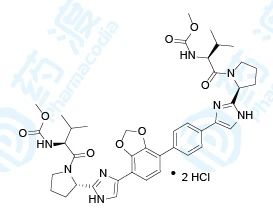
Coblopasvir(盐酸可洛派韦)已经于2019年2月获得NMPA批准上市,用于治疗基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染。该药由北京凯因研发上市,商品名为凯力唯®[20]。
丙肝是一种丙型肝炎病毒HCV引起的血液传播类传染病。感染HCV病毒后的慢性化率为55%~85%,一般人群感染20年后肝硬化发生率为5%~15%,肝硬化患者的HCV相关肝细胞癌(HCC)年发生率为2%~4%[21]。中国是丙肝大国,临床常用抗病毒化药与干扰素相结合的方法,并辅以保肝药物,改善肝功能,防止纤维化。
盐酸可洛派韦是一种NS5A抑制剂,通过抑制NS5A蛋白而阻断HCV病毒的复制和组装。盐酸可洛派韦胶囊的上市有助于增加国内抗丙肝病毒药物可及性,满足临床用药需求。
参考资料
1. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN2709.html (accessed February 2020).
2. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PC567.html (accessed February 2020).
3. Esperion公司:https://www.esperion.com/investors-media/press-releases/ (accessed February 2020).
4. Esperion market research on file: research projectinterviewing 350 physicians. Esperion Therapeutics, Inc. Sept-Oct 2018.
5. Data on file: analysis of NHANES database. EsperionTherapeutics, Inc. 2018.
6. FDA Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/211616s000lbl.pdf(accessed February 2020).
7. FDA Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/211617s000lbl.pdf(accessed February 2020).
8. 药渡数据: https://data.pharmacodia.com/web/basic/basic_detail_PN3656.html (accessed February 2020).
9. Biohaven公司:
https://www.biohavenpharma.com/investors/news-events/press-releases/02-27-2020(accessed February 2020).
10. Biohaven公司:
https://www.biohavenpharma.com/science-pipeline/resources/cgrps-role-migraine(accessed February 2020).
11. FDA Database.
https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/212728s000lbl.pdf(accessed February 2020).
12. 药渡数据: https://data.pharmacodia.com/web/basic/basic_detail_PB0285.html (accessed February 2020).
13. FDA Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/761119s000lbl.pdf(accessed February 2020).
14. Lundbeck公司.
https://investor.lundbeck.com/news-releases/news-release-details/fda-approves-lundbecks-vyeptitm-eptinezumab-jjmr-first-and-only (accessed February 2020).
15. 药渡数据:
https://data.pharmacodia.com/web/basic/basic_detail_PB11178.html (accessed February 2020).
16. 中国疾控:http://www.chinacdc.cn/jkzt/crb/bl/lxxgm/ (accessed February 2020).
17. 美国CDC: https://www.cdc.gov/flu/weekly/index.htm#ILIActivityMap (accessed February 2020).
18. WHO官网:
https://www.who.int/zh/news-room/fact-sheets/detail/influenza-(seasonal) (accessed February 2020).
19. FDA Database. https://www.fda.gov/media/135432/download (accessed February 2020).
20. 药渡数据:
https://data.pharmacodia.com/web/basic/basic_detail_PN3641.html (accessed February 2020).
21. 中国疾控:
http://www.chinacdc.cn/jkzt/crb/zl/bdxgy/bxbdxgy/201906/t20190605_203099.html(accessed February 2020).