
本文由药明康德内容团队编辑
甲基在生物活性分子中普遍存在,根据美国亚利桑那大学Jόn Njarðarson教授团队统计的“2018年全球前200位的药品”,一半以上的药物分子至少包含一个甲基基团。甲基化反应在糖、多肽、核酸、生物碱以及药物分子的结构修饰中得到广泛的研究。在设计候选药物时,甲基化修饰通常用来改善药物分子的生物活性及物理特性。除此之外,甲基化过程还能改变候选药物分子的溶解度、提高药物分子的脱靶选择性,甚至还可以将激动剂转变为拮抗剂等。而在生命科学领域,DNA、RNA的甲基化修饰在基因编辑及调控、疾病诊断等方面发挥重要的作用。
以下列举了几种甲基化药物,有时人们会在药物的代谢热点附近修饰甲基,例如临床用于治疗高胆固醇血症、冠心病的药物simvastatin,其侧链酯基α位修饰另一个甲基后,受位阻效应影响,代谢速率有所降低,因而可延长其半衰期,增加药物作用时间。相反,如果候选药物的半衰期过长,人们可能通过甲基化引入新的代谢热点缩短其半衰期。
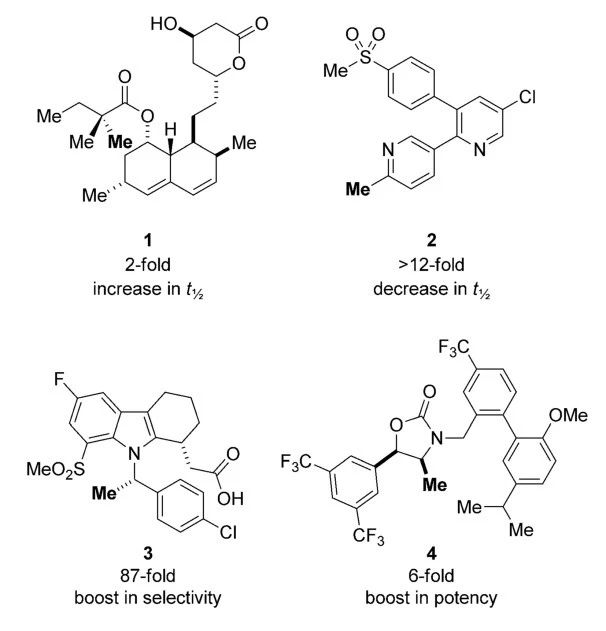
▲甲基化修饰(加重部分)对候选药物分子的药效优化(图片来源:参考资料[1])
研究表明,药物分子中邻近杂原子的位点(如α位)引入甲基通常可以显著改变其药物活性,最为简单高效的方法是直接对相应位点的C-H键进行甲基化,而有效控制反应的区域选择性成为必须解决的关键问题。基于以往发展的甲基化反应,甲基往往需要在合成前期引入目标分子中,目前尚无通用的手段可以实现复杂结构分子的后期修饰。这也便意味着很多母体化合物引入甲基需要从头合成,由此降低了药物研发中药物分子甲基化的效率。

▲图片来源:参考资料[2]
近年来,氮、氧等杂环化合物C(sp3)-H键烷基化反应的研究取得了显著的进展。杂环化合物通常作为亲核试剂与烷基亲电试剂偶联,后者具有良好的底物适用性。相比之下,前者的适用范围则相对有限。以甲基化反应为例,简单的氮杂环化合物可以顺利实现特定位点的C(sp3)-H键烷基化,但当底物结构较为复杂或包含敏感的官能团时,反应效果往往不够理想。
M. Christina White教授团队提出了一种新的甲基化策略:首先在氮、氧杂环化合物的α位引入羟基,随后将其转化为相应的亚铵或氧鎓中间体,此时α位具有较强的亲电活性,便可顺利与亲核甲基化试剂反应得到最终产物。但设计这一过程存在以下问题:目前,人们已发展了一些方法实现杂环化合物的α-C(sp3)-H键羟基化,但大多数工作中结构复杂的底物分子参与反应化学及区域选择性较差。氮、氧杂环化合物α位氧化羟基化形成相应的半胺醛或半缩醛后,受超共轭活化作用的影响,羟基常常会进一步氧化为羰基,因而还需要额外的还原过程。此外,半胺醛或半缩醛还可能发生消除等副反应。
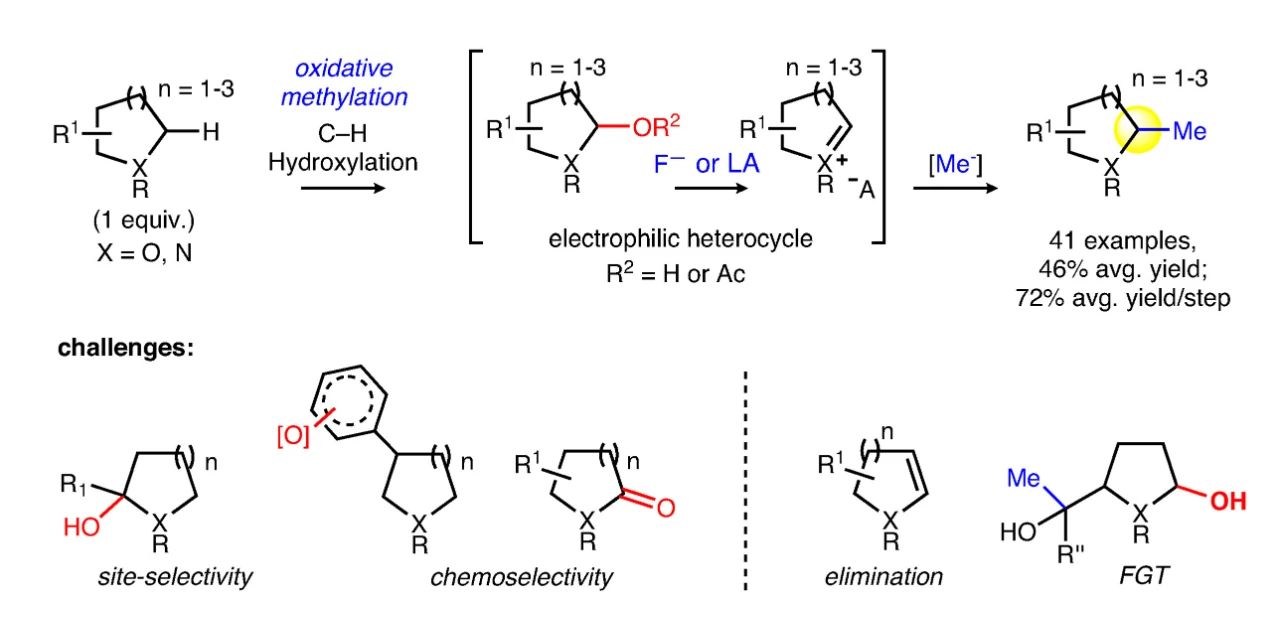
▲甲基化反应的设计思路及面临的挑战(图片来源:参考资料[2])
2019年,该团队利用Mn催化剂1实现了芳香烃分子中非活泼亚甲基C(sp3)-H键的高选择性羟基化。反应具有良好的官能团兼容性,C(sp3)-H键发生氧化时芳香环中的C(sp2)-H键不会受到明显的影响。不过,该方法仅适用于贫电子芳香烃,电中性或富电子芳香烃及部分杂芳香烃参与反应时效果仍需要改善。作者设想将这一催化体系用于杂环化合物的α-C(sp3)-H键羟基化。于是,他们首先以芳基化的γ-内酰胺2作为模板底物,10 mol%的1作为催化剂,5当量的H2O2作为氧化剂,15当量的AcOH作为添加剂,反应得到大量羟基氧化为酮羰基的产物4b;降低催化剂的负载量(0.5 mol%)与H2O2的用量(2当量),反应能以良好的收率得到相应的羟基化产物,羟基不会发生进一步氧化。他们进一步选择DAST或BF3·OEt2作为羟基的活化试剂,促进C-O键断裂形成相应的亚铵中间体。AlMe3作为亲核甲基化试剂亲核活性适中,可兼容其他亲电活性较高的官能团,加上Al原子具有一定的Lewis酸性,同样可辅助C-O键断裂。最终,作者以理想的收率得到目标甲基化产物,其他副反应途径得到了最大程度的抑制。
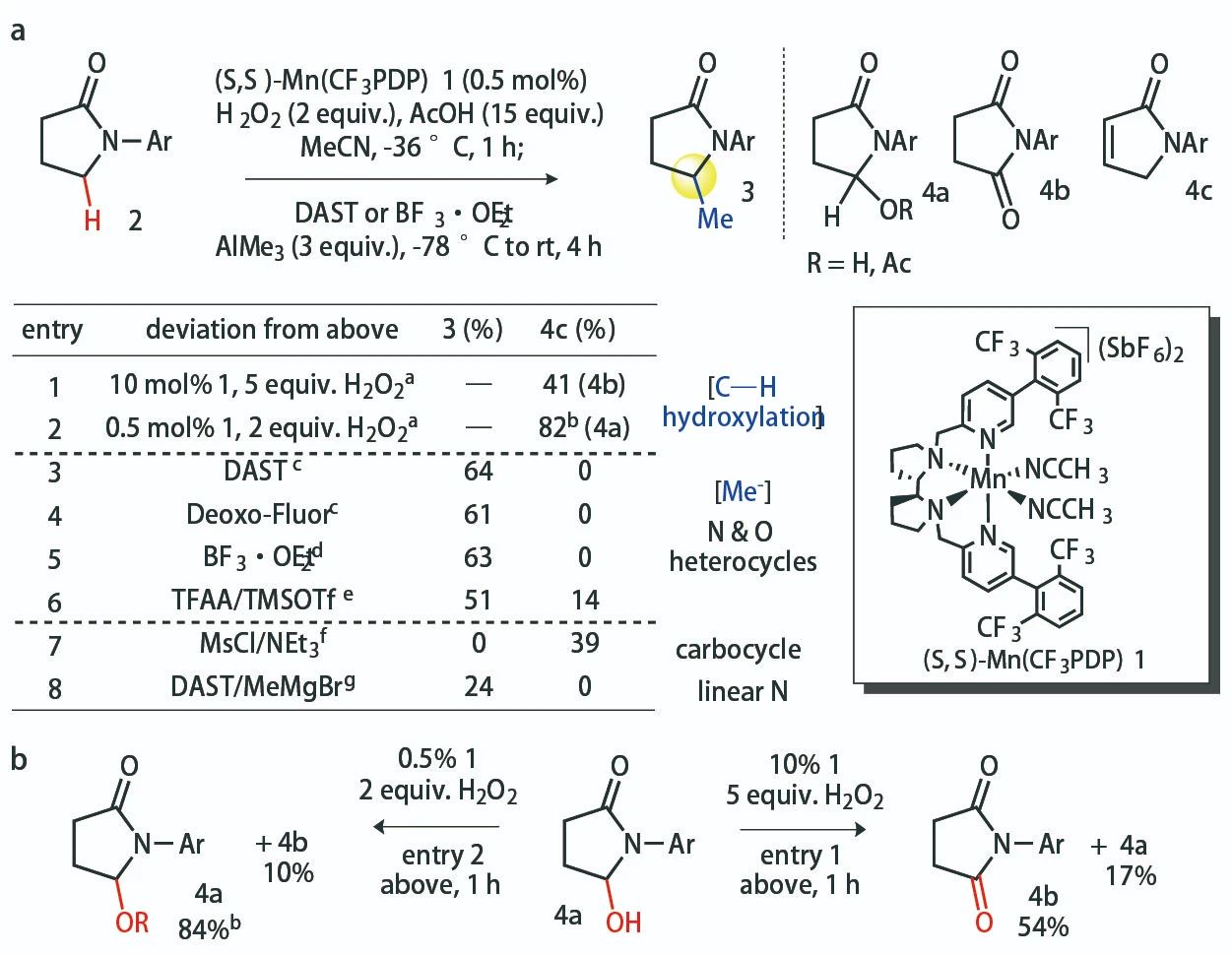
▲反应条件的筛选(图片来源:参考资料[2])
这种甲基化方法对于内酰胺、噁唑烷酮、吡咯烷酮、哌啶等十余种氮、氧杂环类化合物均具有良好的适用性,相应的结构在药物分子中十分常见。反应扩大至克量级规模也不会对产率及选择性带来明显的影响。而使用AlEt3作为乙基化试剂时,同样可以实现相应底物的乙基化。
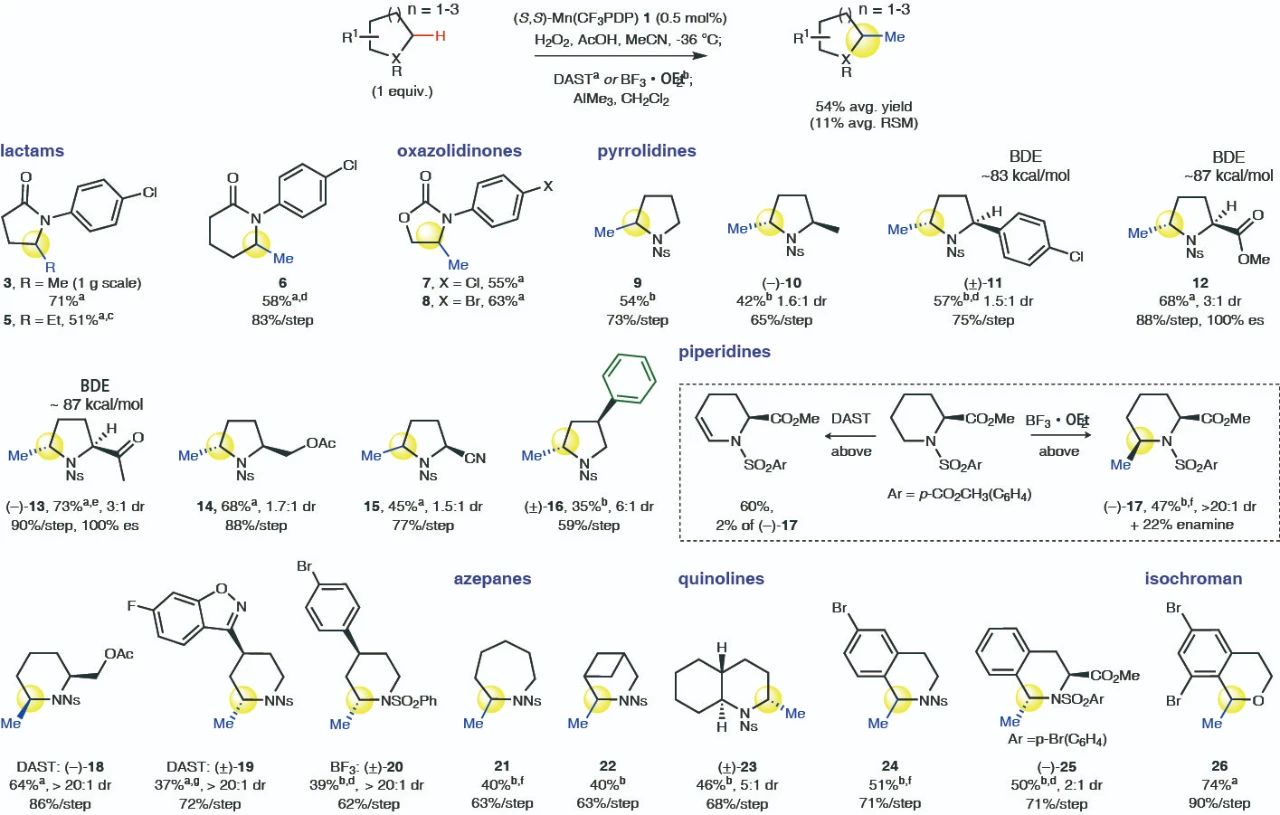
▲杂环底物适用范围的考察(图片来源:参考资料[2])
该反应还可用于天然产物及复杂结构药物分子的后期修饰,大部分情况下均能良好的产率及选择性得到α-甲基化的产物。
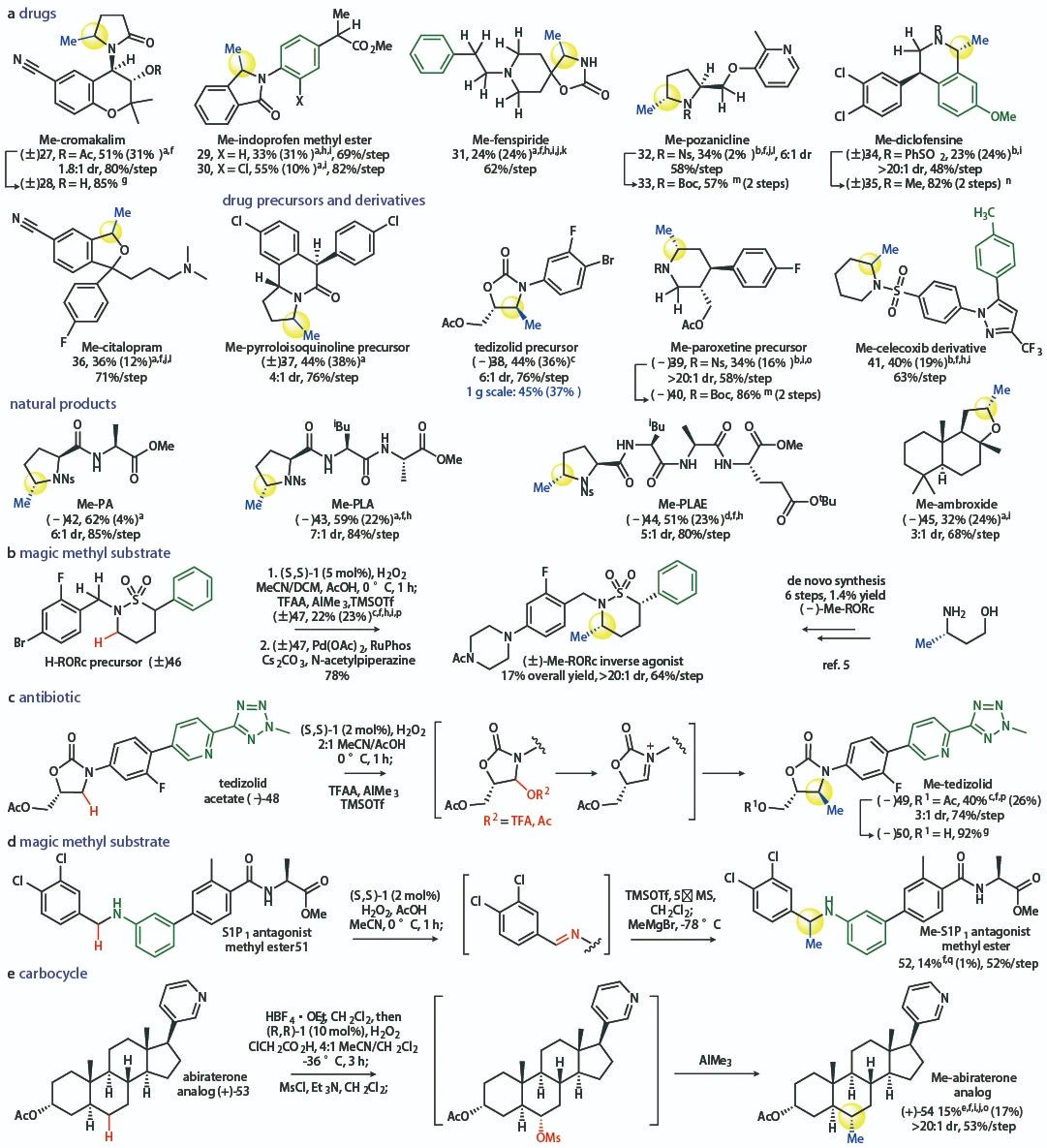
▲复杂结构分子的后期甲基化修饰(图片来源:参考资料[2])
参考资料
[1] Heike Schönherr et al., (2013). Profound methyl effects in drug discovery and a call for new C-H methylation reactions. Angew. Chem. Int. Ed., DOI: 10.1002/anie.201303207[2] Kaibo Feng et al., (2020). Late-stage oxidative C(sp3)–H methylation. Nature, DOI: 10.1038/s41586-020-2137-8